ニュース&イベント NEWS & EVENTS
ホタテガイから抗凝固活性を有する希少なフコシル化ヘパラン硫酸の同定に成功
~未利用資源であるホタテガイ中腸腺の有効活用へ~
研究の要旨とポイント
- グリコサミノグリカンは機能性食品や医薬品、化粧品として広く活用されていますが、供給源は生物由来原料に限られることから、代替資源の探索が求められています。
- ホタテガイの非食部位である中腸腺からグリコサミノグリカンを抽出し、世界で初めてフコシル化ヘパラン硫酸を同定しました。
- 今回得られたフコシル化ヘパラン硫酸は、血液の抗凝固作用、および神経突起伸長促進作用を示しました。
- 未利用資源であるホタテガイの中腸腺は、極めて珍しいフコシル化ヘパラン硫酸の貴重な供給源となることが期待されます。
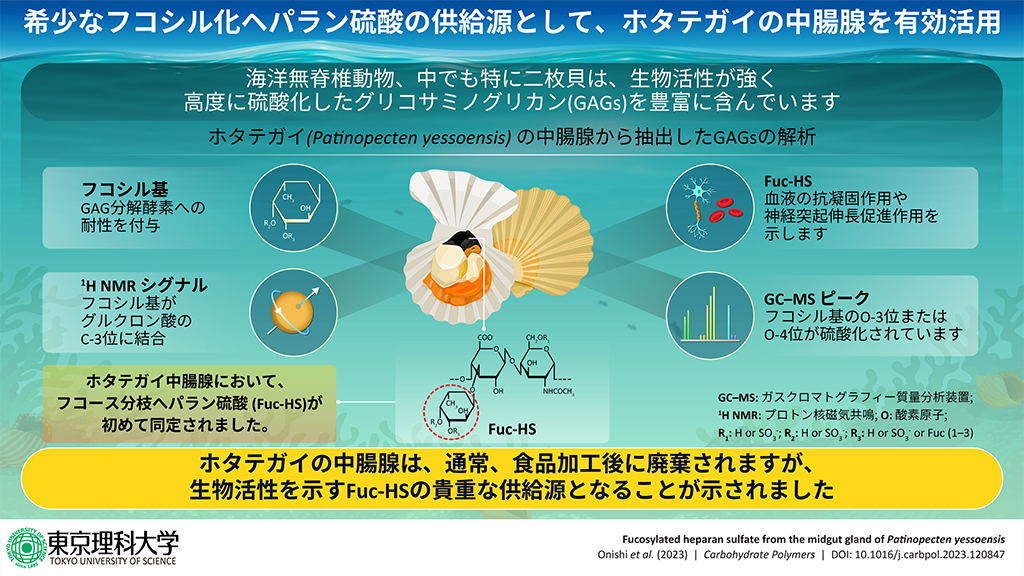
東京理科大学薬学部の東恭平准教授、和田猛教授、佐藤一樹講師、東京農工大学農学部の宮田真路准教授らの研究グループは、一般に「ウロ」と呼ばれ、食品加工時に廃棄されるホタテガイの中腸腺から、グリコサミノグリカン(Glycosaminoglycans: GAGs)を抽出しました。そこから、通常のヘパラン硫酸(*1)に硫酸化フコースが結合した、極めて珍しい「フコシル化ヘパラン硫酸(Fucosylated heparan sulfate: Fuc-HS)」を同定しました。
GAGsはコンドロイチン硫酸 (CS)、ヘパラン硫酸 (HS)、ヘパリン、ヒアルロン酸と呼ばれる直鎖状の酸性糖鎖の総称です。GAGsは機能性食品や医薬品、化粧品として広く流通していますが、その供給源は生物由来原料に限られていることから、代替資源の探索が求められています。例えば、血液の抗凝固活性を有するヘパリンのほとんどは中国産ブタの小腸粘膜から調製されますが、その供給はアフリカ豚熱の脅威に晒されています。
海洋無脊椎動物は体内に高度に硫酸化したGAGsを含み、一部の二枚貝では抗凝固活性を有するヘパリンを生合成することが知られています。そのため、ヘパリンの代替資源の探索を目的に軟体類に含まれるGAGsとその凝固活性が古くから調べられてきましたが、ホタテガイについてはほとんど検討されていませんでした。また、ホタテガイの中腸腺はカドミウムなど毒の蓄積源とされ、食品加工時に通常廃棄されます。
そこで本研究では、ホタテガイの中腸腺より糖鎖を抽出し、その構造を解析しました。その結果、硫酸化フコースがヘパラン硫酸に結合したFuc-HSを世界で初めて同定しました。これまで、硫酸化フコースが修飾されたGAGsとして、ナマコ由来のフコシル化コンドロイチン硫酸(Fucosylated chondroitin sulfate: Fuc-CS)が知られており、今回得られたFuc-HSはフコシル化GAGsとして2例目となります。ナマコ由来Fuc-CSは市販の脊椎動物由来CSに比べて強い抗凝固活性、抗HIV活性、血糖降下作用、血管新生作用、抗炎症作用、神経突起伸長促進作用(*2)など多彩な生物活性を有することから、これまで多くの注目を集めてきました。今回、ホタテ中腸線より同定したFuc-HSにおいても、血液の抗凝固作用や神経突起伸長促進作用があり、その生物活性は硫酸化フコースに依存することが分かりました。生物活性をもつ極めて珍しいFuc-HSの供給源として今後の有効活用が期待されます。
本研究成果は、2023年3月25日に国際学術誌「Carbohydrate Polymers」にオンライン掲載されました。
研究の背景
GAGsは、ウロン酸とアミノ糖の二糖単位の繰り返し構造からなる直鎖状の酸性多糖であり、ヘパラン硫酸(HS)、コンドロイチン硫酸(CS)、ヘパリン、ヒアルロン酸などが知られています。HSやCSなどの硫酸化GAGsは、動物体内では、コアとなるタンパク質に結合したプロテオグリカンとして存在し、軟骨、皮膚、および血管などで組織の保水性や弾力性を維持しています。従って、GAGsの構造変化は炎症をはじめとした様々な生理過程に関与しています(※1)。
研究グループは、これまで様々な動物組織、特に未利用資源からGAGsを抽出し、その構造を解析することで、機能性食品や医薬品、化粧品などに向けた新しいGAGs供給源の探索を行ってきました(※2)。東准教授は、このような生物活性を有する糖鎖構造を網羅的に解析することで、糖鎖機能の解明とその応用を目指しています。
(過去のプレスリリース)
(※1)「脳梗塞急性期における炎症憎悪に血管内腔の糖衣損傷が関与することを解明〜糖衣保護を目的とした新規の脳梗塞治療薬の開発に期待〜」
(※2)「機能性成分コンドロイチン硫酸およびプロテオグリカンの代替的資源候補の発見〜未利用資源であるチョウザメ頭部軟骨の有効活用へ〜」
研究結果の詳細
ホタテガイ由来GAGの構造解析
岩手県産ホタテガイ(Patinopecten yessoensis)の中腸腺から、アセトンによる脱脂、アクチナーゼEによるタンパク質分解、エタノール沈殿、透析、陰イオン交換クロマトグラフィーを経て、酸性糖鎖画分を抽出しました。その酸性糖鎖画分を HS特異的分解酵素(ヘパリナーゼ)またはCS特異的分解酵素 (コンドロイチナーゼ)で処理後、セルロースアセテート膜電気泳動を行いました。ブタやサメ由来HSやCSは、酵素処理により分解されるとそのバンドは消失します。一方で、ホタテガイ由来糖鎖画分のバンドはコンドロイチナーゼ、又はヘパリナーゼ処理を行った場合においても消失しませんでした。ナマコ由来Fuc-CSはコンドロイチナーゼによる分解に抵抗性を示しますが、低濃度の硫酸により酸加水分解を施すとフコースが外れ、コンドロイチナーゼへの感受性が増すことが報告されています。そこで、硫酸で穏やかに酸加水分解した後、セルロースアセテート膜電気泳動を行いました。その結果、驚いたことに、ホタテガイ由来酸性糖鎖画分のバンドはコンドロイチナーゼではなく、ヘパリナーゼで処理した場合に消失しました。次に、ホタテガイ由来酸性糖鎖画分をヘパリナーゼ処理により生じる不飽和二糖をHPLCで測定した結果、酸加水分解により不飽和二糖の量が著しく増加しました。これらの結果から、ホタテガイ由来酸性糖鎖画分の主要成分はHSであり、そのHSはフコシル化されている可能性が考えられました。
次に、得られたホタテガイ由来HSの糖鎖構造を1H-NMRで調べました。その結果、フコシル基のH-6メチルプロトンに相当するシグナル(1.2-1.3 ppm)が検出されました。HSはグルクロン酸とN-アセチルグルコサミンの二糖繰り返し構造から成りますが、グルクロン酸のH-2(3.39 ppm)とH-3(3.59 ppm)のシグナルが小さくなっていたことから、ホタテガイ由来HSはグルクロン酸のC-3位にフコシル基が側鎖として結合していることが考えられました。
さらに、ホタテガイ由来Fuc-HSに結合したフコシル基の結合様式と硫酸基の位置を調べるため、Fuc-HSを部分メチル化した後にGC/MS分析で調べました。その結果、Fuc-HSではフコシル基の3位または4位が硫酸化されていることが分かりました。
ホタテガイ由来Fuc-HSのもつ生物活性の検討
ヘパリンはアンチトロンビンとの結合を介して、トロンビン(活性化第II因子、IIa)や活性化第X因子(Xa)などの働きを阻害することで、血液の抗凝固作用を示します。ナマコ由来Fuc-CSも抗凝固活性を示すことから、Fuc-HSの抗凝固活性を調べました。その結果、Fuc-HSは、未分画ヘパリンほどではないものの高濃度(>100μg/mL)で抗凝固活性を示し、その活性はFuc-HSを脱フコシル化(穏やかな酸加水分解)することで消失しました。また、Fuc-HSの抗凝固活性は、ナマコ由来Fuc-CSやフコイダン(*3)よりも強いものでした。この結果は、硫酸化フコース部位がアンチトロンビンとの結合に必要であることを示唆しています。
また、ナマコ由来Fuc-CSは、マウスニューロンの神経突起伸長促進作用をもつことが報告されています。そこで、ホタテガイ由来Fuc-HSの神経突起伸長促進作用を調べたところ、Fuc-CSと同程度の活性が認められました。一方、ブタ小腸粘膜由来HSではそのような活性は認められませんでした。この結果は、硫酸化フコース部位が神経突起伸長促進作用を発揮することを示唆します。
本研究について、東准教授は「ホタテガイの中腸腺は、極めて珍しいFuc-HSの供給源として今後の有効活用が期待されます。また、天然に存在する新しい糖鎖構造とその生物活性を解明することで、糖鎖医薬品を開発する上でのヒントが得られます」と本研究の将来性と、天然に存在する新たな糖鎖構造の更なる探究について期待を寄せています。
用語
*1 ヘパラン硫酸
グリコサミノグリカンの一種で、グルクロン酸(またはイズロン酸)とN-アセチルグルコサミンの二糖単位が繰り返された骨格に、硫酸基が付加した構造をもつ。
*2 神経突起
神経細胞において核を含む細胞体から長く伸びる突起(樹状突起)のこと。神経細胞は、この神経突起を介して他の神経細胞と接続し、情報伝達を行う。
*3 フコイダン
フコースを主成分とした硫酸化多糖で、コンブやワカメなど褐藻類に多く含まれる。
論文情報
雑誌名
Carbohydrate Polymers
論文タイトル
Fucosylated heparan sulfate from the midgut gland of Patinopecten yessoensis
著者
Shoichi Onishi, Kento Shinoya, Kazuki Sato, Ayumu Mubuchi, Shiori Maruyama, Tadaaki Nakajima, Masahiro Komeno, Shinji Miyata, Kazumi Yoshizawa, Takeshi Wada, Robert J. Linhardt, Toshihiko Toida, Kyohei Higashi
