ニュース&イベント NEWS & EVENTS
脳梗塞急性期における炎症増悪に血管内腔の糖衣損傷が関与することを解明
~ 糖衣保護を目的とした新規の脳梗塞治療薬の開発に期待~
- ●脳梗塞急性期における脳血管内腔の糖衣損傷が、脳梗塞の炎症増悪に関与することを解明しました。
- ●梗塞巣ではヘパラナーゼ (HPSE)およびヒアルロニダーゼ1 (HYAL1)の活性が増加すること、および不活性型のHPSE前駆体 (pro-HPSE)はアクロレインによって活性化されることを発見しました。
- ●Pro-HPSEを標的とした糖衣保護剤が開発されれば、酸化ストレス除去剤との併用により脳梗塞の炎症抑制が可能になると期待されます。
東京理科大学薬学部薬学科の東恭平講師、理化学研究所環境資源科学研究センターの堂前直ユニットリーダー、鈴木健裕専任技師、東京薬科大学薬学部/大学院薬学研究科の降幡知巳教授、千葉大学予防医学センターの戸井田敏彦特任教授、株式会社アミンファーマ研究所の五十嵐一衛代表取締役社長らの研究グループは、脳梗塞急性期における脳血管内腔の糖衣の損傷が、炎症増悪に関与することを解明しました。この糖衣損傷には、ヘパラナーゼ (HPSE: へパラン硫酸分解酵素)およびヒアルロニダーゼ1 (HYAL1:コンドロイチン硫酸分解酵素)の活性増加が関与することを明らかにしました。詳細を調べた結果、不活性型のHPSE前駆体 (pro-HPSE)は、脳梗塞時に生じるアクロレイン(ACR)によって活性化されることを発見しました。
脳梗塞は、脳の血管が閉塞するなどして血流が滞る「虚血」によって発生します。虚血に陥ると、患部の脳細胞は酸欠状態となり壊死します。脳梗塞時には、虚血に続いて起こる炎症により病態が悪化します。この炎症の拡大は、免疫細胞が脳組織内へ侵入することで始まると考えられています。
脳毛細血管では、血管最内層を構成する内皮細胞が密着結合によって互いに強固に結合し、「血液脳関門」と呼ばれるバリアを構成しています。これにより、血液中に存在する免疫細胞は、通常は脳内に侵入できませんが、虚血により壊死した細胞から損傷関連分子パターン(DAMPs)と呼ばれる物質が放出されると、このバリアが破壊されて侵入が可能になります(超急性期:発症後数時間以内)。脳内に侵入した免疫細胞は、DAMPsによりさらに活性化され、脳内に炎症を広げていきます(急性期および亜急性期:12〜72時間)。
このように、脳梗塞では血液脳関門の破壊を発端に、炎症が拡大していきます。したがって、脳血管の損傷を防ぐことが炎症増悪を阻止するうえで重要です。
脳毛細血管の内皮細胞表面に存在する糖衣は、酸性糖鎖であるグリコサミノグリカンで構成されており、免疫細胞との不要な接着を妨げる役割があります。グリコサミノグリカンには、ヘパラン硫酸(HS)、コンドロイチン硫酸(CS)、およびヒアルロン酸 (HA)などがあります。
本研究では、脳梗塞モデルマウスの梗塞巣ではHSおよびCSの分解が生じ、それが炎症増悪に関与することを明らかにしました。また、ヒト不死化脳血管内皮細胞を用いて、酸化ストレス (特にアクロレイン)による糖鎖の分解機構を調べました。
研究の背景
虚血によって脳細胞が壊死すると、脳血液関門の機能が破綻して免疫細胞が脳組織内に侵入することで炎症が増悪すると考えられていましたが、その詳細は明らかになっていませんでした。
血管内皮細胞に存在する糖衣は免疫細胞の不要な接着を妨げる機能があり、その分解は炎症増悪に関与することがタンパク尿や敗血症で報告されていました。しかし、脳梗塞の重症度と糖衣の関連性についてはほとんど調べられていませんでした。そこで本研究では、脳梗塞モデルマウスとヒト不死化脳血管内皮細胞を用いて、脳梗塞急性期における糖衣の分解とそのメカニズムを調べました。
研究結果の詳細
<脳梗塞モデルマウスを用いた実験>
まず、光増感反応を応用したPhotochemically induced thrombosis (PIT)法により作製した脳梗塞モデルマウスを用いて、脳梗塞とグリコサミノグリカンの構造に関連性があるかどうかを調べました。梗塞誘導24時間後に梗塞巣を摘出し、グリコサミノグリカンであるHS、CS、およびHAの糖鎖構造と発現量を調べました。その結果、梗塞巣では健常脳組織と比較して、HSおよびCSの発現量が著しく減少していました。HSやCSの糖鎖構造 (硫酸化パターン)、およびHAの量に変化は認められませんでした。また、このマウスの血漿中HSおよびCS濃度を調べると、発症3〜24時間後まで両者ともにその濃度は増加し続けていました。この結果は、梗塞巣で分解されたHSおよびCSが血液中に遊離したためと考えられます。このことから、脳梗塞急性期において、梗塞巣でHSおよびCSの分解が起きていることが分かりました。
次に、HS、CS、およびHAに対する糖鎖分解酵素について調べました。HS分解酵素であるHPSE、CSおよびHA分解酵素であるHYAL1、HA分解酵素であるHYAL2について、梗塞巣における発現量を、ウェスタンブロット法を用いて調べました。すると、梗塞巣では健常組織と比較して、HYAL1の発現量が発症3時間後および24時間後でともに増加していました。HYAL2の発現量に変化は認められませんでした。HPSEはこの方法では検出できませんでしたが、HPSEの酵素活性は、梗塞巣では健常組織と比較して発症3時間後および24時間後で上昇しました。そこで、免疫組織化学染色法によりHPSEの発現を調べたところ、梗塞巣の毛細血管ではHPSEの発現が増加していました。
さらに、血管内皮細胞の糖衣損傷と脳梗塞増悪の関係を調べました。脳梗塞では、虚血に陥り酸素が不足していた組織に血流が再開(虚血再灌流)されますが、その際、酸素の供給により様々な活性酸素種 (過酸化水素: H2O2、スーパーオキサイド、ヒドロキシラジカル)が産生されます。また、脂質過酸化反応やポリアミンの酸化分解から毒性の強い不飽和アルデヒドであるアクロレイン(ACR)も産生されます。活性酸素種やACRは細胞を傷害し、細胞死を引き起こします。そのため、酸化ストレス除去剤が脳梗塞時の治療に用いられます。本実験では、酸化ストレス除去剤としてN-アセチルシステイン(NAC)とともに、HPSE阻害剤 (低分子ヘパリン)およびHYAL1阻害剤 (低分子コンドロイチン硫酸)を組み合わせて投与しました。すると、各処置による梗塞巣体積の減少量は、(NAC+HPSE阻害剤+HYAL1阻害剤)>(NAC+HPSE阻害剤)>NAC単独(35%減少)>HPSE阻害剤単独(効果なし)となりました。
これらの結果から、脳梗塞時に血管内皮細胞の糖衣を構成するHSとCSが、それぞれHPSE、HYAL1によって分解されることにより、炎症が増悪することが示唆されました。
<内皮細胞を用いた実験>
まず、ヒト不死化脳毛細血管内皮細胞(HBMEC/ciβ)を用いて、細胞増殖に対するH2O2、またはACR曝露の影響を調べました。すると、40μMのACRで処理したとき、および80μMのH2O2で処理したとき細胞増殖が強く阻害されました。
次に、糖衣に対する酸化ストレスの影響を調べるため、HBMEC/ciβ細胞におけるHSおよびCSの発現量を調べました。その結果、HSの発現量はACR処理により減少しましたが、CSの発現量は変化しませんでした。また、HSおよびCSの発現量は H2O2処理では変化しませんでした。一方、虚血再灌流(H/R)処理を施したところ、ACR処理したときと同様にHSのみ発現量が減少しました。
さらに、各分解酵素に対する酸化ストレスの影響を調べました。HPSEは、HS切断活性がない不活性型の前駆体(pro-HPSE)として生合成されます。その後、pro-HPSEはHSプロテオグリカンと結合した状態で細胞膜上に局在します。pro-HPSEはHSプロテオグリカンと共に取り込まれた後にリソソーム内でカテプシンLにより切断を受け、内部の6-kDaリンカーが除かれると活性型のHPSEとなります。通常、HPSEはリソソームに局在します。HBMEC/ciβ細胞にACRを曝露するとHS量が低下したため、HPSEおよびpro-HPSEの発現量をウェスタンブロット法を用いて調べました。その結果、ACR処理したものでは未処理のものと比較してpro-HPSEの発現量は増加したものの、HPSEの発現量に変化は認められませんでした。ACRを曝露した細胞におけるHPSE mRNAの発現量を調べると、未処理のものと比較してmRNA量が増加しました。また、H/R処理によってもHPSE mRNAの発現量は増加しました。このことから、ACR処理によるpro-HPSEの発現量増加は、mRNAの発現亢進によるものと考えられました。
研究グループはさらに、HPSE遺伝子を形質導入したHEK293細胞にヘパリンを添加して培養し、培養液中に分泌されたpro-HPSEの活性を調べました。その結果、ACRを添加するとその濃度に依存してpro-HPSEの糖鎖切断活性が上昇しました。このことから、ACRはpro-HPSEを活性化することが分かりました。pro-HPSEのどのアミノ酸にACRが付加しているのか、nano LC-MS/MSによりペプチドを解析したところ、pro-HPSEはACRによって15カ所のリジン残基が修飾されていました。特に小サブユニットと大サブユニットをつなぐ6-kDaリンカーの両端に位置するリジン残基が修飾されており、その修飾によりリンカーの立体構造が変化し、pro-HPSEの酵素活性が生じたと考えられます。
本研究に関し東講師は、「pro-HPSEを標的とした有効な糖衣保護薬が開発されれば、酸化ストレス除去剤との併用により、脳梗塞患者のQOL(Quality of Life)向上が期待される」としています。
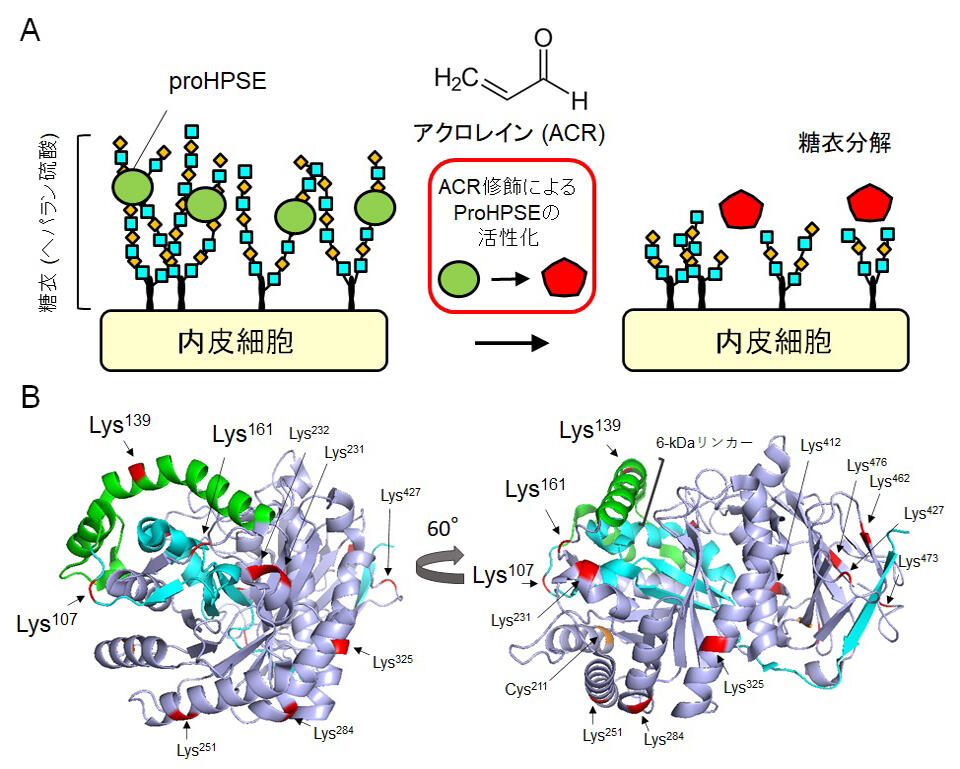 |
図. 脳梗塞急性期における糖衣損傷機構。(A) ProHPSEはヘパラン硫酸プロテオグリカンに結合して細胞膜上に局在するが、脳虚血により産生されたACRにより修飾を受けると活性化して糖鎖を分解する。 (B) proHPSEの構造とアクロレイン修飾部位. ACRが結合したリジン残基を赤で示す。 ProHPSEは6-kDaリンカー (緑)の両端に位置するリジン残基 (Lys107, Lys161)がACRにより修飾されると、タンパク質の立体構造が変化し、活性化すると考えられる。8-kDa サブユニット (シアン)、50-kDa subunit (ライトブルー)。
論文情報
| 雑誌名 | : | Journal of Biological Chemistry |
|---|---|---|
| 論文タイトル | : | Ischemic stroke disrupts the endothelial glycocalyx through activation of proHPSE via acrolein exposure |
| 著者 | : | Kenta Ko, Takehiro Suzuki, Ryota Ishikawa, Natsuko Hattori, Risako Ito, Kenta Umehara, Tomomi Furihata, Naoshi Dohmae, Robert J. Linhardt, Kazuei Igarashi, Toshihiko Toida and Kyohei Higashi |
| DOI | : | 10.1074/jbc.RA120.015105 |
東研究室
東講師のページ:https://www.tus.ac.jp/fac_grad/p/index.php?7015
東京理科大学について
東京理科大学:https://www.tus.ac.jp/
詳しくはこちら
