ニュース&イベント NEWS & EVENTS
植物がDNA損傷から身を守る、新規のエピジェネティクス制御メカニズムを解明
~植物に多様なストレス耐性を付加でき、食糧生産にも貢献できる~
- ●植物のDNA損傷修復を促進するタンパク質(LDL1)を同定し、新規のエピジェネティクス制御のメカニズムを明らかにしました。
- ●DNA修復因子RAD54が損傷領域へと集まる際には、エピジェネティック修飾の一種であるメチル化されたヒストンが目印となっており、LDL1がヒストンからメチル基を除去することで、RAD54をDNA損傷領域から解離させ、DNA修復をスムーズに進めることもわかりました。
- ●LDL1を活用することで、植物のエピジェネティック修飾を人工的にコントロールでき、多様なストレス耐性を植物に付加し、世界の農業生産にも大きく貢献する可能性があります。
植物は、一つの場所に根を張り、動物のように動き回ることが出来ません。そのため、気候が変化したり、病原菌や虫が襲ってきたり、根元の土の栄養が失われたり、といった環境ストレスに晒されても、逃げることが出来ません。じっと耐えて自分の生命を守るしかないのです。こうした環境ストレスの多くは、放射線や紫外線などと同様に、植物細胞のDNAに損傷をもたらします。動けない植物がその場で生き残っていくためには、こうしたDNAの損傷に対応していくことがとても重要です。
細胞内のDNA損傷応答では、DNAの鎖が切れてしまったときに修復するプロセスの1つである「相同組換え(HR)」、DNAから遺伝子の読み出しを調節する「エピジェネティック修飾」、といった機構が重要な役割を果たします。こうしたDNAの修復にかかわるタンパク質は、損傷部位を正確に突き止めることが求められますが、その分子メカニズムには、まだ不明の点が多く残されていました。
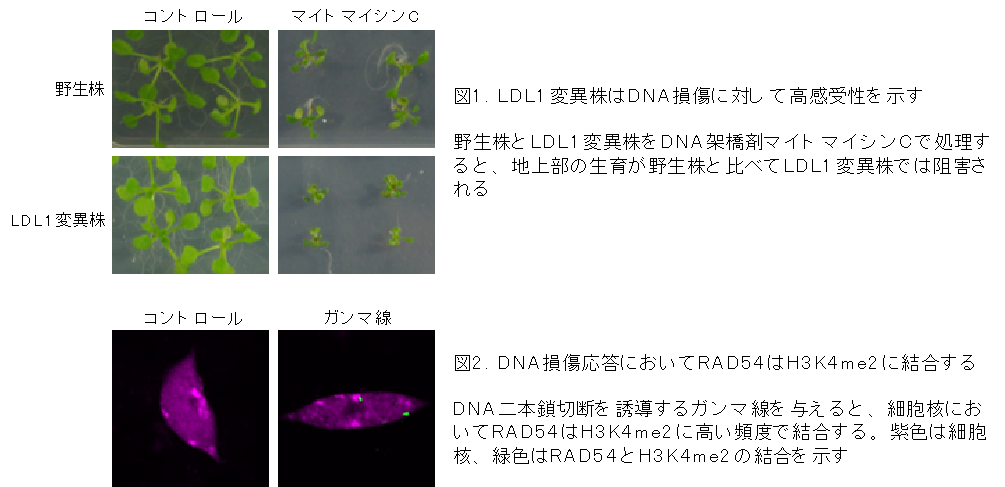
東京理科大学理工学部応用生物科学科の松永幸大教授の研究グループは、新規のエピジェネティクス制御のメカニズムを明らかにしました。DNA修復因子RAD54が損傷領域へと集まる際には、エピジェネティック修飾の一種(ヒストンのメチル化:H3K4me2)が目印となっており、また、ヒストン脱メチル化酵素LDL1(lysine-specific demethylase 1-like 1)がヒストンからメチル基(H3K4me2)を除去することで、RAD54をDNA損傷領域から解離させ、DNA修復をスムーズに進めることもわかりました。
本研究により、エピジェネティクス制御によって植物のDNA損傷応答を改善できることが明らかになりました。農作物を改良して、生育性を高めたり、長寿にしたり、より良い性質を持たせて、世界の食料安定性に貢献することが出来ると期待されます。
【研究の背景】
植物は、さまざまな高温や低温、乾燥、病原体、寄生虫、土壌状況の悪化、などの環境ストレスを避けられず、植物が自分の命を守るためには、その場で環境ストレスに対応するしかありません。自然界の放射線や紫外線はDNAを損傷しますが、環境ストレスの多くもDNAに損傷をもたらし、植物の発生や成長を阻害します。そのため、植物が変動する環境下で生育し生存し続ける上でDNA損傷応答は極めて重要です。
DNAは2本のポリヌクレオチド鎖がらせん状に絡まり合った構造をしていて、互いに塩基配列を相補し合っているので、1本が損傷しただけなら、もう一本の情報を元に修復できます。しかし、2本とも切れて損傷しまったときは深刻な状況です。DNAが2本とも切れてしまうことを、DNA二重鎖切断(DNA double-strand breaks:DSBs)といいます。DNA二重鎖切断になってしまったときは、速やかに修復しないと、大切な遺伝情報が失われ、細胞に死をもたらす恐れもあります。
このDNA二重鎖切断を修復する機構は、植物だけでなく、微生物から哺乳類に至るまで、真核生物全般に見られる大切な機構で、大きく分けて2つの種類があります。1つ目は、とにかく近くにあるDNAの端どうしを繋ぐ、非相同末端結合です。2つ目は、切れたDNAの部分と同じ配列を持つDNA鎖を見つけて、それを鋳型にして正確に繋ぎなおす、相同組換え(Homologous Recombination:HR)です。
HRは、ゲノムの完全性や多様性を保つために鍵となるプロセスです。本研究で登場する、DNA修復因子RAD54は、クロマチン再構築因子であり、同じ塩基配列を持つDNAを探し、遺伝毒性ストレスを防ぐなど、HRで重要な役割を果たすタンパク質です。
二重らせん構造のDNAは、「ヒストン」というタンパク質に左巻きに約1.6回ずつ巻き付いて、長いDNAをコンパクトに納める「クロマチン」という構造を形作っています。ちょうど、DNAがワイヤーだとすると、ヒストンという真珠の粒をワイヤーで巻き付けながら作られた首飾りのようなものに似ているかもしれません。
このクロマチン構造のDNAから、遺伝子情報の読出しを調節する重要な機構が「エピジェネティクス制御」です。エピジェネティクス制御では、クロマチン構造のどこかに化学的な修飾が行われてクロマチン構造が変化し、ヒストンに巻き付いたDNAが緩んだり引き締まったりすることで、遺伝子の発現が調節されます。この修飾を「エピジェネティック修飾」と呼び、DNAの側にメチル基が付いて修飾されることを「DNAメチル化」、メチル基が取れることを「脱メチル化」、ヒストンの側に化学的な修飾がなされることを「ヒストン修飾」といいます。
植物を含む真核生物では、DNA損傷の修復に働くタンパク質は、クロマチンの中から損傷部位を正確に認識する必要がありますが、その分子メカニズムには不明な点が多く残されています。また、DNA損傷の際のエピジェネティック修飾のメカニズムは、完全にはわかっていませんでした。
【研究の詳細】
松永教授の研究グループは、シロイヌナズナを研究材料としました。シロイヌナズナは高さ10~30センチほどに成長し、小さな白い花を咲かせる顕花植物です。遺伝子数が少なく、ゲノムサイズも小さいこと、室内で簡単に育てることが出来、生育も速く、種子がたくさん取れること、形質転換も容易であることなどから、研究用のモデル植物として広く使われています。
本研究グループは以前、シロイヌナズナのDNA修復因子RAD54が、損傷が生じたクロマチン領域に特異的に集積することを明らかにしていました(Hirakawa et al, 2017)。その際、DNA修復因子RAD54は損傷クロマチン領域に特異的に集まり、細胞核内でドット状の構造体(RAD54フォーサイ)を形成することがわかっていました。RAD54フォーサイは植物細胞のDNA損傷の応答能や感受性を知る上で有用なマーカーとなりましたが、「どのようにして損傷領域を認識するのか?」という根本的なメカニズムはわかっていませんでした。また、RAD54が効果を発揮するためには、新しいものを適切に補充することと、HRサイトからの分離が、どちらも重要ですが、補充と分離のことは良くわかっていませんでした。
研究グループは今回、共免疫沈降法や質量分析法などの手法を用いて、HRによるDNA損傷修復の際にRAD54と相互作用して、RAD54とクロマチンとの動態を制御するタンパク質がないか、調べていきました。そして、ヒストン脱メチル化酵素であるLDL1がRAD54と相互作用することを突き止めました。RAD54の損傷領域への集積には、クロマチンの4つのコアヒストンのうち、ヒストン修飾の一種であるヒストンH3の4番目のリジン残基のジメチル基(H3K4me2)が目印として機能することを明らかにしました。H3K4me2の脱メチル化は動植物に広くみられるエピジェネティック修飾の一種で、これまでは主に遺伝子発現制御との関係が盛んに研究されていました。
余分なRAD54がDNAの周囲を覆ってしまうと、損傷修復の妨げになりますが、ヒストン脱メチル化酵素LDL1がヒストンH3からH3K4me2を脱メチル化して除去することで、RAD54を損傷領域から解離させてDNA修復を促進することもわかりました。
松永教授は、「私たちが明らかにした新しいエピジェネティック調節のメカニズムは、植物のDNA損傷修復にかかわるもので、実世界での応用範囲もとても多いと考えています。また、今回の研究成果は、DNA損傷応答におけるメチル化されたヒストンの役割の一端を明らかにしたものであり、植物科学だけでなく、基礎生物学全般において重要な知見になると考えられます。」と述べています。
植物のエピジェネティック修飾を人工的にコントロールするために、LDL1を活用することができるはずです。化合物処理などによりエピジェネティック修飾を人工的に植物に導入することで、感染、環境ストレス、機械的ストレスなど、多様なストレスへの耐性を植物に付け加えることができると期待されます。ストレス耐性の高い植物が次々と生み出されれば、世界の食物生産にも大きく向上し、人々の生活に安心と豊かさをもたらすでしょう。
【論文情報】
| 雑誌名 | : | Plant Physiology |
|---|---|---|
| 論文タイトル | : | LDL1-mediated H3K4me2 demethylation is required for homologous recombination repair in Arabidopsis |
| 著者 | : | Takeshi Hirakawa1,†, Keiko Kuwata2, Maria E. Gallego3, Charles I. White3, Mika Nomoto4, Yasuomi Tada4, Sachihiro Matsunaga1,* |
| 所属 | : | 1. 東京理科大学 理工学部 応用生物科学科 2. 名古屋大学 トランスフォーマティブ生命分子研究所 3. フランス クレルモン大学 4. 名古屋大学 遺伝子実験施設 † 現所属 奈良先端科学技術大学院大学 日本学術振興会特別研究員PD * 責任著者 |
| DOI | : | https://doi.org/10.1104/pp.19.00530 |
【資料】
 |
松永研究室
研究室のページ:https://www.rs.tus.ac.jp/sachi/
松永教授のページ:https://www.tus.ac.jp/fac_grad/p/index.php?64d9
東京理科大学について
東京理科大学:https://www.tus.ac.jp/
ABOUT:https://www.tus.ac.jp/info/index.html#houjin
関連記事
-

2025.04.28
全結合型イジングマシンLSIシステム、容量と精度のデュアルスケーラブル化に成功
~社会のあらゆる組合せ最適化問題に挑む~研究の要旨とポイント クラウドと異なり、エッジ環境では電力や設置形態に制約があるため、問題の特性に応じて容量(スピン数)と精度(相互作用ビット幅)を最適化することが重要です。 今回、容量と精度の両方向に展開できる画期的なデュアルスケーラブル…
-

2025.04.25
科学研究費助成事業(特別研究促進費)に採択
本学が代表機関となり 2025年大船渡市山林火災の総合調査研究を実施今般、東京理科大学創域理工学研究科 国際火災科学専攻の桑名 一徳教授らの研究グループは、文部科学省による科学研究費助成事業(特別研究促進費) に採択されました。 採択された研究課題「2025年大船渡市山林火災の総合調査研究」は、本年2月に発…
-

2025.04.22
ガンダムカラーの環境センサー(TEM)が宇宙へ
~国際宇宙ステーション内の空気環境を測定する軌道上実証を予定~東京理科大学、高砂熱学工業株式会社、大和大学ほか6機関からなる「TEAM SPACE LIFE」(TSL)が開発した小型自律分散型環境センサー(TEM: TSL Environment Monitor)が、4月21日17時15分(日本時間)…
