ニュース&イベント NEWS & EVENTS
B型肝炎ウイルスが肝臓の受容体を認識するユニークな段階的相互作用を解明
国立健康危機管理研究機構
公立大学法人横浜市立大学
国立大学法人東京大学
東京理科大学
研究成果のポイント
- B型肝炎ウイルスが標的肝細胞を認識し、強く結合するための、ユニークな仕組みを解明しました。
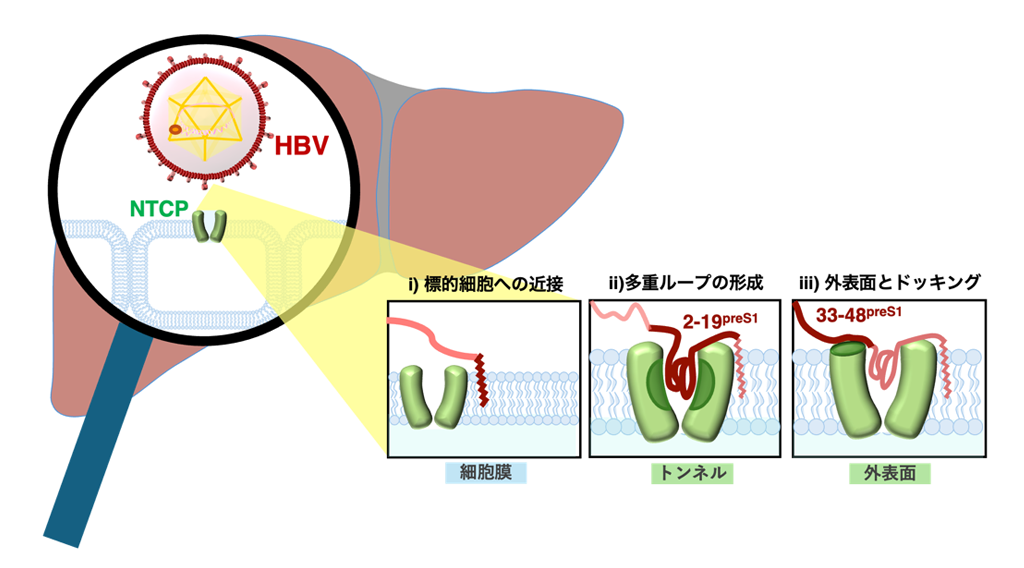
- B 型肝炎ウイルスはその粒子上の長鎖ペプチドで、1)まず標的細胞表面に脂質成分を介して緩く近接、2)肝細胞表面の受容体が持つトンネル内に多重ループ構造を形成して広い表面積で結合、3)さらに外側ペプチドがトンネル外表面の窪みにドッキングと、標的への結合を段階的に増強させていく特徴を持つことが明らかになりました(図1)。
- これは、B型肝炎ウイルスが標的肝細胞のみを効率よく認識・感染するメカニズムを明らかにしたものであり、HBV感染を阻害する治療薬のデザイン・開発につながると期待されます。
概要
国立健康危機管理研究機構 国立感染症研究所 治療薬開発研究部の小林ちさ博士(当時:東京理科大学大学院 創域理工学研究科 大学院生)、渡士幸一部長らは、横浜市立大学大学院生命医科学研究科 浴本亨助教、池口満徳教授、朴三用教授、東京大学大学院総合文化研究科 大岡紘治特任助教、新井宗仁教授、神戸医療産業都市推進機構、国立感染症研究所 ウイルス第二部、東京大学大学院新領域創成科学研究科、京都大学大学院医学研究科、フランス トゥール大学、理化学研究所らと共同で、ウイルス学、構造生物学、計算科学、統計力学の多分野融合解析により、B型肝炎ウイルス(HBV)のユニークな受容体(注1)認識機構を解明しました。
HBVは肝臓に高い感染性を示し、持続感染によって肝がんを引き起こします。今回の研究では、HBVがウイルス粒子表面の柔軟に動くペプチドを利用し、これを標的肝細胞の受容体のかたちに合わせて入り組んだ多重ループへと変化させ、それによってお互いに強く噛み合う相互作用を段階的に構築していくプロセスを解明しました。他のウイルスにはない「相手に柔軟に合わせて相互作用を獲得する」特徴は、HBVが肝臓のみを見分けて標的に強く感染する仕組みの一つと考えられます。この知見は新たなワクチンや治療薬のデザイン・開発につながると期待されます。
発表内容
HBVの持続感染者は世界に約2.5億人、その慢性感染を原因とする肝硬変や肝細胞がん発症による死者は年間約110万人と推計され、HBV感染制御は世界の公衆衛生における重要な課題です。現行の治療薬はウイルスの複製を止めることで肝疾患発症の低下に有効であるものの、肝がん発症を完全に阻止し、ウイルスを体内から排除する効果的な治療薬は存在しません。
粒子表面に長い「触手」を持つHBVは、感染者体内で感染標的細胞を探しながら血中を流れています。この触手は長鎖表面抗原のpreS1と呼ばれる脂質ペプチドであり、特にその最末端部の「ミリストイル基(脂質)と2–48アミノ酸領域(ペプチド)」が、肝細胞表面上の胆汁酸輸送体(Sodium taurocholate co-transporter polypeptide: NTCP)を受容体として認識・結合し、細胞内へ侵入します。この「preS1による受容体NTCPの認識」は、HBVが感染可能な動物や宿主細胞を見分け、肝病態進行を決定する重要なイベントであり、抗ウイルス薬開発の魅力的な標的です。我々はこれまで、2022年にNTCPが9回膜貫通構造と、中央に胆汁酸が通過するトンネルを持つことを、2024年にpreS1は複雑な多重ループ構造を形成してNTCPと結合することを明らかにしてきました(図2)。しかしながら、preS1がどのような過程でこの複雑な構造をとり、標的に結合・感染するかは不明でした。本研究ではウイルス学、構造生物学、計算科学、統計力学の解析を利用して、preS1は複数の分子内領域を順序立てて標的各部位に相互作用し、段階的に標的結合力を高めていくことを解明しました。
まず、細胞での結合実験から、受容体であるNTCPとの結合にはpreS1のペプチド部位(2–48アミノ酸領域)が関わること、しかしながら脂質部位(ミリストイル基)がないとNTCP発現細胞への結合性が完全に失われることがわかりました。つまり、ミリストイル基がpreS1を標的膜に近接させることが示されました。
次にペプチド部位の中で、最初の18アミノ酸(2–19アミノ酸領域)がNTCPに結合すること、この結合には特に3つのアミノ酸(9番目アスパラギン、12番目グリシン、17番目ヒスチジン)が鍵となっていることが明らかになりました。構造的には、この3つのアミノ酸はNTCPのトンネル内部でpreS1の多重ループを束ねる「コア構造」となっており(図2)、NTCP側トンネル面のアミノ酸(31番目ロイシン、264番目グルタミン)に両側から挟まれてトンネル内部に固定されます。分子動力学シミュレーション(注2)により、このコア構造はpreS1分子内とNTCPトンネル表面との双方の相互作用によって、NTCPとの結合を安定化させることが示唆されました。これら3つのアミノ酸のいずれかを変異させ、コア構造を形成できなくなったウイルスは、細胞およびヒトNTCPトランスジェニックマウス(注3)のいずれにも完全に感染性を失ったことから、コア構造の形成とそれによるNTCP内トンネルとの相互作用は、ウイルス感染性のもとになっていることがわかりました。
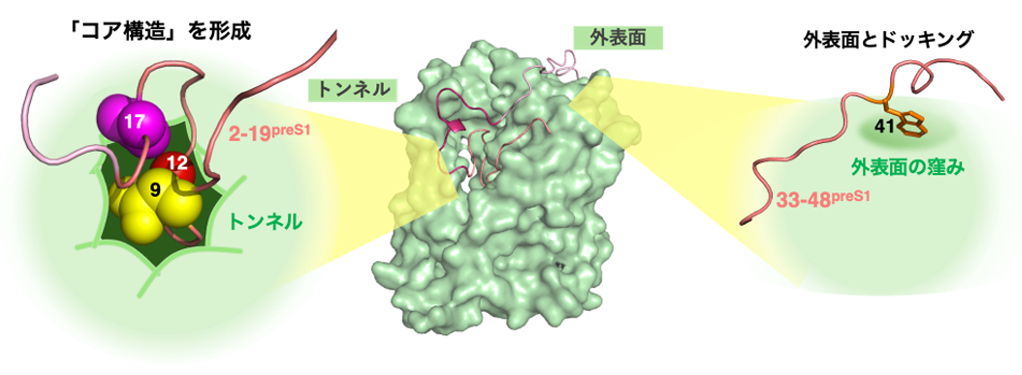
HBV preS1は2–19アミノ酸領域が「コア構造」を形成することでNTCPのトンネルに深くはまり、
さらに33–48アミノ酸領域がNTCP外表面の窪みにドッキングし、非常に強固にNTCPに結合する。
さらに分子動力学シミュレーションおよびウイルス感染実験から、上記の相互作用に加えて、よりC末端側のトンネル外に出ているペプチド部位(33–48アミノ酸領域)がNTCPとの結合力をさらに高めることがわかりました。この領域はこれ自体ではNTCPに結合する能力はありませんが、上記2–19アミノ酸領域の結合を足場として、特に41番目トリプトファンがNTCPのトンネル外表面の浅い窪みにドッキングすることによって、preS1のNTCPへの結合がさらに安定することが示唆されました(図2)。また複合体構造をもとにした統計力学モデル(注4)解析でも、preS1はNTCPと結合する際にはまず7–19アミノ酸領域が多重ループを形成し、徐々に他の領域も構造をとり、最後に33–48アミノ酸領域の構造形成をもって完成することが推定され、preS1各領域のNTCPへの多段階結合の順序が理論的にも支持されました。
以上のことから、preS1は、1)まず緩やかに標的細胞膜へ接近(ミリストイル基と細胞膜との相互作用)し、2) NTCPと強い結合を形成(2–19アミノ酸領域の多重ループ構造形成とNTCPトンネル内部面との相互作用)、3)さらに結合の安定化(33–48アミノ酸領域がトンネル外表面の窪みにドッキング)を介して、結合を成熟させていくと考えられます。つまり、preS1はそのかたちを変えながら、各領域が標的に強く噛み合うように段階的に結合を強化し、標的細胞と特異的かつ強固に結合すると考えられます。
多くのウイルスは、すでに決まった構造を持つ粒子表面タンパク質が、すでに決まった構造の宿主細胞の受容体にジグソーパズルのように結合します。一方でHBVは、決まった構造をとらずに自由自在に動くpreS1をうまく使って、標的への結合を段階的に強化させていくと考えられます。本研究で明らかになった多段階結合モデルは、HBVの高い感染種/臓器指向性と粒子の高い感染性を説明するものです。この結果は、HBVの感染過程を標的としたワクチンや治療薬のデザイン・開発に有用な情報を提供するものです。
発表者・研究者等情報
- 国立健康危機管理研究機構
- 国立感染症研究所 治療薬開発研究部
渡士 幸一 部長
論文情報
雑誌名
Nature Communications
題名
Multistep receptor binding of the hepatitis B virus preS1 domain
著者名
Chisa Kobayashi, Toru Ekimoto, Koji Ooka, Junki Mifune, Kayo Matsuzawa, Lusheng Que, Yingfang Li, Atsuto Kusunoki, Takeshi Morita, Kaho Shionoya, Makoto Nagano, Kousho Wakae, Masanori Isogawa, Masamichi Muramatsu, Umeharu Ohto, Norimichi Nomura, Sam-Yong Park, Camille Sureau, Munehito Arai, Mitsunori Ikeguchi, Koichi Watashi*
DOI
研究助成
本研究は、国立研究開発法人日本医療研究開発機構(AMED) 肝炎等克服実用化研究事業、文部科学省 科学研究費助成事業などの支援により実施されました。
用語解説
(注1)受容体
ウイルスが宿主細胞に感染する際に利用する、タンパク質や糖鎖などの分子。通常、ウイルスごとに特異的な受容体があり、ウイルス粒子表面の分子が細胞表面の受容体を認識し、結合することで感染が開始されます。ウイルスの伝播性や感染指向性、病原性を決定する重要な要因の一つです。
(注2)分子動力学シミュレーション
分子や原子の経時的な運動を計算によって再現する解析手法。実験では観測が難しい現象の解析に用いられます。
(注3)ヒトNTCPトランスジェニックマウス
ヒトNTCPを発現させた遺伝子組み換えマウス。HBV表面抗原の役割を解析するため、感染実験に用いられます。
(注4)統計力学モデル
分子や原子の振る舞いを統計的に扱い、その性質を解析予測する手法。
