ニュース&イベント NEWS & EVENTS
金錯体を用いた精密合成により高い円偏光発光を示すキラルナノフープの創製に成功
~環状π共役分子の後期修飾を可能にする新しい分子設計基盤~
東京理科大学
大阪公立大学
北里大学
研究の要旨とポイント
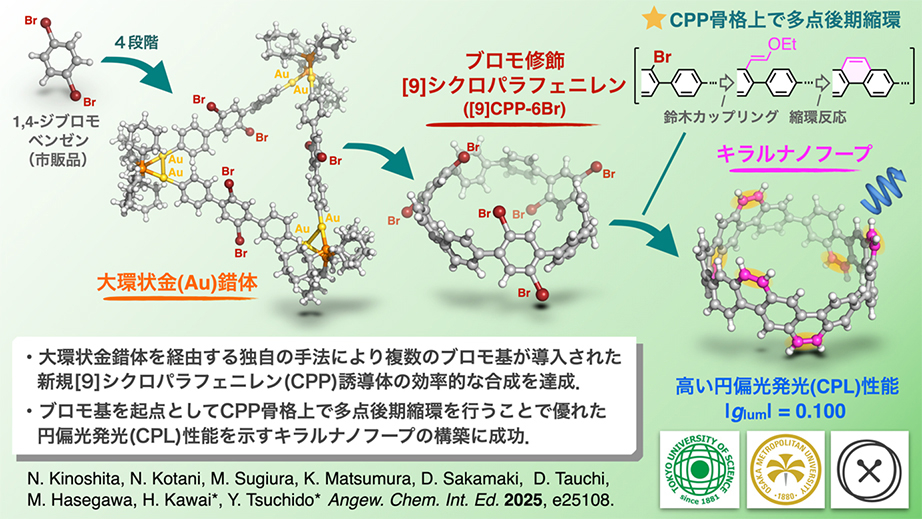
- 独自に開発した「大環状金錯体法」を駆使し、6つの臭素原子(ブロモ基)を精密に配置した新規シクロパラフェニレン誘導体([9]CPP-6Br)の効率的な合成を達成しました。
- [9]CPP-6Brのブロモ基を反応点として、多点での鈴木カップリングおよび縮環反応により、新規アームチェア型キラルナノフープの構築に成功しました。
- 得られたキラルナノフープは、レアアースなどの希少金属を含む有機金属化合物に匹敵する水準の高い円偏光発光(CPL)性能を示し,有機キラル光学材料の分野に新しい分子設計指針をもたらしました。
研究の概要
東京理科大学大学院 理学研究科化学専攻の木下 尚哉氏(2023年度 修士課程修了)、小谷 菜々美氏(2025年度 修士課程2年)、同大学 理学部第一部化学科の河合 英敏教授、土戸 良高講師らの研究グループは、金錯体を活用した独自の合成戦略により、6つの臭素原子を精密に配置した[9]シクロパラフェニレン([9]CPP)の開発に成功しました。
本分子は、多点でのクロスカップリングが可能な環状π共役構造のプラットフォームとして機能し、後期段階でのπ共役拡張(late-stage π-extension)を通じて、強い円偏光発光(CPL)を示す新しいキラルナノフープ分子の創製につながりました。
本成果は、環状π共役分子の官能基設計とキラル光機能材料の融合を実現する新しい分子構築法として大きな意義を持ちます。
本研究は、東京理科大学・大阪公立大学(酒巻 大輔准教授)・北里大学(長谷川 真士教授、田内 大喜助教)の共同研究として行われ、研究成果は、2025年12月30日に国際学術誌「Angewandte Chemie International Edition」にオンライン掲載されました。
研究の背景
シクロパラフェニレン(cycloparaphenylene, CPP)(*1)は、ベンゼン環がパラ位で環状に連結された構造をもつ環状π共役分子です。環状に湾曲したπ共役系によりCPPは従来の直鎖状π共役分子とは異なる特徴的な電子的・光学的性質を示すことで知られています。例えば、環のサイズや導入する置換基に応じてその発光波長や電子状態(エネルギー準位)が大きく変化することが報告されています。さらに、環構造全体にキラル構造を付与することで、円偏光発光(circularly polarized luminescence, CPL)(*2)などのキラル光学特性の精密制御も可能になります。
このような構造 − 機能相関に基づき、CPPは分子エレクトロニクス、次世代光機能材料、キラル光学デバイスの開発といった応用面でも高いポテンシャルを持っており、合成化学、物性化学、材料科学などの広範な研究分野で大きな注目を集めています。
CPP骨格に複数の置換基を精密に導入することができれば、電子状態や光物性を自在に制御した「新規機能性π共役分子」の創製につながります。しかし、その実現には大きな課題が存在していました。
CPPはベンゼン環が湾曲した構造をもつため、その合成は難しく、複数箇所に選択的な官能基修飾を施すことが極めて困難です。分子骨格が完成した後に、精密な官能基導入を行う「後期修飾(*3)」を達成できれば、CPPを共通プラットフォームとして多様なπ拡張構造やキラルナノフープを効率的に構築することが可能になります。
しかし、既存のCPP合成法では後期修飾の起点となる反応性の高い置換基を導入することが難しく、さらに反応位置の制御や反応選択性、大量生産の面でも技術的なハードルが高く、CPPの応用展開を阻む主要な課題の一つとされてきました。
このような背景のもと、CPP骨格に対して複数点での精密な置換基導入を可能にする新しい合成基盤の開発が求められていました。
本研究グループでは、2020年に大環状金錯体を経由した独自のCPP合成法を報告しました。この手法は穏和な反応条件下でCPP骨格を形成できることから、これまでに多様な置換基をもつCPP誘導体の合成に寄与してきました。
今回、我々はこの合成法をさらに発展させ、CPP骨格上の特定位置に六つの臭素原子を精密に配置した[9]CPPの合成に成功しました。
本分子は、後期修飾のための反応点を複数かつ等間隔に備えており、CPPを起点とする多点π拡張を実現する上で極めて有用なプラットフォームとして機能します。実際、本分子を出発点としてパラジウム触媒を用いたクロスカップリングおよび六重縮環反応によるπ拡張(*4)を行うことで、高い円偏光発光(CPL)を示すアームチェア型の新しいキラルナノフープ分子の創製につながりました。
研究結果の詳細
はじめに、独自開発したCPP合成法を用いて、CPP骨格の特定位置に6つの臭素原子を精密に配置した新規[9]シクロパラフェニレン誘導体([9]CPP-6Br)を合成しました。
具体的には、市販入手可能な1,4-ジブロモベンゼンを原料とし、大環状金錯体の形成を経由することで5段階反応で[9]CPP-6Brを高収率(総収率37%)かつサブグラムスケールで合成しました(図1a)。
興味深いことに、合成した[9]CPP-6Brは室温においてほとんど蛍光を示しませんでした。これは強い蛍光を示す[9]CPPとは対照的な結果であり、6つの臭素原子の導入によって重原子効果(heavy-atom effect)が強く働き、系内での項間交差(ISC:intersystem crossing)が著しく促進されていることを示唆しています。
そこで、[9]CPP-6Brの2-メチルテトラヒドロフラン溶液を液体窒素温度まで冷却しながら紫外光を照射したところ、温度の低下に伴い発光色が徐々に変化し、低温領域(83 K以下)では623 nm付近に明確なリン光(燐光,phosphorescence)が観測されました(図1b)。CPP誘導体においてリン光が観測される例は極めて少なく、本結果は臭素原子による重原子効果が三重項状態からの放射遷移を促進したことを示しています。このように,[9]CPP-6Brは後期修飾のための多点反応場だけでなく、リン光特性を示す機能性材料であることが明らかとなりました。
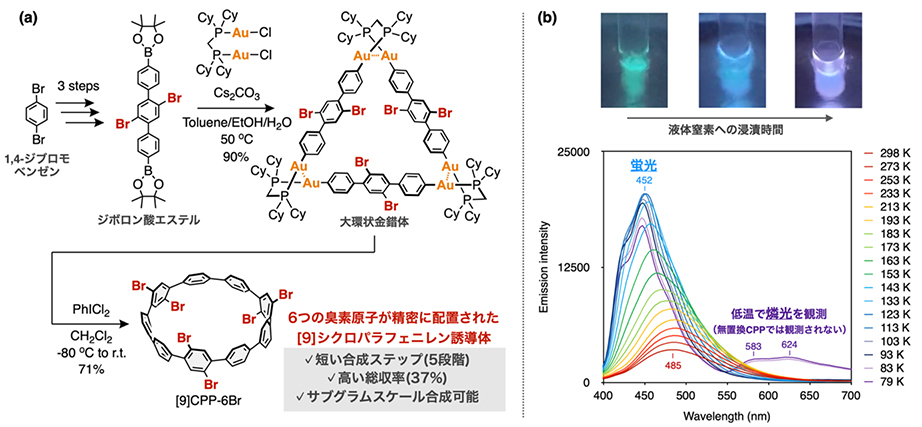
(a) 大環状金錯体を鍵中間体とする[9]CPP-6Brの高効率合成ルート
(b) 液体窒素で冷却しながら紫外線を照射した際に観察される[9]CPP-6Brの2-メチルテトラヒドロフラン溶液の発光色変化(上)と温度可変発光スペクトル(下)
次に、[9]CPP-6Brの後期修飾のプラットフォームとしての性能を評価するため、パラジウム触媒を用いたクロスカップリング(*5)を検討しました。その結果、エチニルベンゼンとの薗頭カップリング(57%)、4-メトキシフェニルボロン酸(54%)および(E)-(2-エトキシビニル)ボロン酸ピナコールエステル(72%)との鈴木‐宮浦カップリングが高効率で進行し、分子内の全てのブロモ基を、エチニル基、アリール基、エトキシエテニル基に一挙変換させることができました(図2a)。
これらの反応では6箇所すべてが変換されることから、各結合形成は90%前後の高い変換効率で進行したことになります。この結果は、[9]CPP-6BrがCPP骨格を基盤とした多点後期修飾の出発分子として、優れたプラットフォームであることを強く示すものです。
さらに、得られた多置換CPP誘導体のうち、エトキシエテニル基を導入した化合物に対してBi(OTf)3を用いた分子内縮環反応を行ったところ、CPP骨格上で同時に6箇所が縮環する多点反応が進行し、新規キラルナノフープ分子が生成しました。
この化合物は三つの縮環ユニット(dibenz[a,h]anthracene)が環状に連結したアームチェア型構造をもち、縮環ユニットの回転異性に基づく立体配座により4種類のアトロプ異性体が存在します(図2b)。
これらの異性体を、キラルHPLCによって分割を行い、キラル光学特性の評価を行いました。その結果、これらの異性体は比較的強い緑色蛍光(ΦF = 0.30)を示し、特にD3対称性をもつ異性体において|glum| = 0.100(*6)という、大きい非対称性因子をもつ円偏光発光(CPL)が観測されました(図2c)。一般的なキラル有機分子では、左右の円偏光の強さの差は 0.1% 未満(|glum|〜 0.001)にとどまります。一方、本研究で得られた値(|glum| = 0.100)は、左右の円偏光の強さに 約 5% の差があることに相当します。この値はキラル有機分子の中でもトップクラスに位置するものであり、本手法による後期π拡張を通じて、優れたキラル光学特性をもつナノカーボン分子が創製可能であることを示す成果といえます。
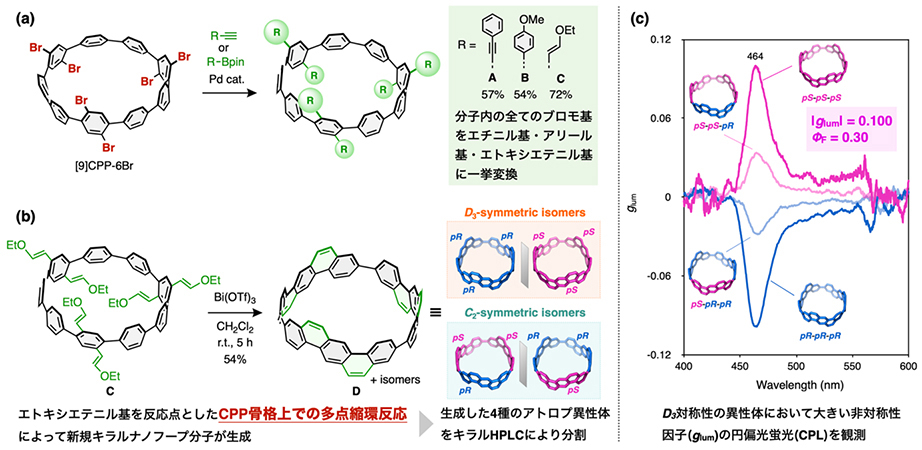
(a) クロスカップリングによる多点後期修飾
(b) 六重縮環反応を用いたπ拡張による新規キラルナノフープ分子Dの合成
(c) キラルHPLCで分割した化合物Dの各アトロプ異性体の円偏光発光(CPL)スペクトル
社会的なインパクト
本研究の特徴は、研究グループが独自開発した大環状金錯体を経由したCPP合成法の、高い官能基許容性を活用することにより、多点修飾可能な[9]CPP-6Brを実験室レベルの設備においてサブグラムスケールで合成を可能にした点です。
従来、CPPは高度に歪んだ環状構造であるがゆえに合成が難しく、特に複数の反応点を精密に配置した誘導体を大量に供給することは困難でした。この量的制約は、CPPを出発点とした後期修飾化学、および機能性材料開発を進める上で大きな障壁となっていました。
本研究で提示した多点修飾可能なCPPの合成戦略は、材料開発・応用研究の加速に大きく寄与するものと期待されます。
さらに、本研究で合成したキラルナノフープが示した非常に高いCPL特性は、次世代ディスプレイ、ホログラフィー、情報暗号化、光学的キラリティーセンシングなどにおいて、重要な役割を果たす可能性があります。
本研究は、ナノカーボン科学、光機能材料、キラルテクノロジーといった多様な領域への波及効果を持つ、学術的かつ社会的インパクトの高い成果といえます。
今後の展望
本研究で確立したCPPの後期π拡張手法により、これまで合成が困難であった芳香環の縮環位置や、置換基の種類を自在に変化させた多様なナノフープ分子やより複雑な環状π共役ネットワークの構築を可能にすると期待されます。
また、キラル光学特性のより一層の増強や、発光波長のチューニングなど、目的に応じた分子設計が可能になるといえます。
さらに、CPP骨格を基盤とした多点修飾戦略は、ナノカーボン材料の構造設計にも新たな展開をもたらす可能性があり、将来的にはカーボンナノチューブのボトムアップ型合成への応用へとつながる可能性があります。
※ 本研究は、科研費基盤研究(C)(21K05093)、科研費学術変革領域(A)高密度共役(20H05866, 21H05496, and 23H04041)、徳山科学技術振興財団 研究助成、東京理科大学若手・女性研究者奨励金、人・環境と物質をつなぐイノベーション創出ダイナミック・アライアンスの助成を受けて実施したものです。
用語
*1 シクロパラフェニレン(cycloparaphenylene, CPP)
ベンゼン環がパラ位で環状につながった分子で、カーボンナノチューブの最小構造単位に相当する。湾曲したπ共役系を持ち、特異な電子的・光学的性質を示す。
*2 円偏光発光(circularly polarized luminescence, CPL)
右回り・左回りの円偏光を放射する発光現象。3Dディスプレイ、ホログラフィー、光情報処理、キラルセンシングなどの次世代光学デバイスとして注目されている。
*3 後期修飾
分子骨格を完成させた後に特定部位へ官能基を導入する手法。
*4 π拡張
芳香環単位を縮環させ、分子全体のπ電子系を拡げる手法。光学特性や電子物性が大きく変化するため、機能性材料の設計において重要。
*5 クロスカップリング
金属触媒(主にパラジウム)を用いてハロゲン化芳香族と有機金属試薬を結合させる反応。鈴木–宮浦カップリングは、有機ホウ素化合物を芳香族ハロゲン化物に結合させる反応で、アリール基やビニル基の導入に広く用いられている。薗頭カップリングは末端アルキンを芳香族ハロゲン化物に結合させる反応で、エチニル基の導入に広く用いられる。
*6 glum値(CPL異方性因子)
CPLの偏りの度合いを示す指標で、左円偏光(IL)と右円偏光(IR)の発光強度差を正規化した値。glum = 2(IL − IR)/(IL + IR)。値が大きいほど円偏光発光の偏りが強く、高性能CPL材料の評価尺度となる。通常のキラル有機分子の多くは、glum値が10-3オーダーであり、本研究で達成した10-1オーダーという値は有機分子では極めて異例である。これはレアアースなどの希少金属を含む有機金属化合物に限られて観測される水準であり、加工性に優れた有機分子でこのような大きなglum値が報告された例は、過去にごくわずかしか存在しない。
論文情報
雑誌名
Angewandte Chemie International Edition
論文タイトル
A Precisely Bromo-Functionalized [9]Cycloparaphenylene as a Platform for Late-stage Multisite π-Extension Toward Chiral Nanohoops
著者
Naoya Kinoshita‡, Nanami Kotani‡, Masaya Sugiura, Kotaro Matsumura, Daisuke Sakamaki, Daiki Tauchi, Masashi Hasegawa, Hidetoshi Kawai* and Yoshitaka Tsuchido*
‡N. KinoshitaとN. Kotaniは等しい貢献度
DOI
発表者
- 木下 尚哉
- 東京理科大学大学院理学研究科化学専攻(2023年度 修士課程修了)
- 小谷 菜々美
- 東京理科大学大学院理学研究科化学専攻(2025年度 修士課程2年)
- 杉浦 雅弥
- 東京理科大学大学院理学研究科化学専攻(2025年度 修士課程1年)
- 松村 虎太朗
- 東京理科大学大学院理学研究科化学専攻(2025年度 博士後期課程3年)
- 酒巻 大輔
- 大阪公立大学大学院理学研究科化学専攻 准教授
- 田内 大喜
- 北里大学理学部化学科 助教
- 長谷川 真士
- 北里大学理学部化学科 教授
- 河合 英敏
- 東京理科大学理学部第一部化学科 教授
- 土戸 良高
- 東京理科大学理学部第一部化学科 講師
