ニュース&イベント NEWS & EVENTS
1,2-ジクロロプロパン曝露による胆管がん発症にはたらく遺伝子群を特定
~免疫細胞を介してDNA損傷を引き起こす発がん物質の検出~
研究の要旨とポイント
- 職業性胆管がんの原因物質である1,2-ジクロロプロパン(DCP)が、胆管がんを引き起こす際にはたらく遺伝子群を、トランスクリプトーム解析により特定しました。
- 胆管細胞と免疫細胞であるマクロファージを共培養し、DCPに曝露することにより、胆管細胞ではDNA修復関連遺伝子群の発現が、マクロファージでは細胞周期関連遺伝子群の発現が上昇しました。
- 本研究の実験系を用いることにより、これまで見逃されてきた未知の発がん物質を検出でき、新しい職業がんの発生を未然に防ぐことが可能となります。
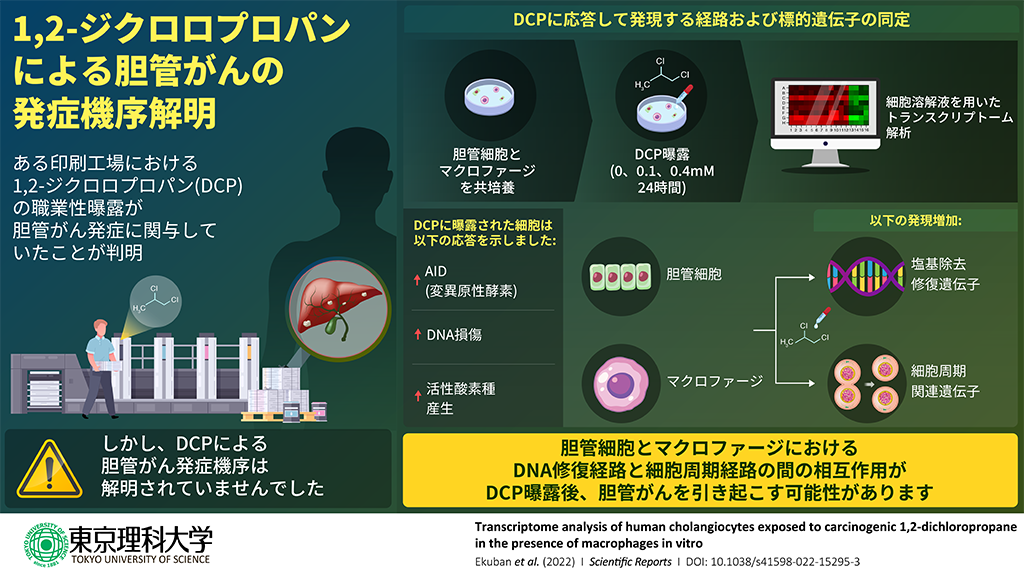
東京理科大学薬学部の市原学教授、同大学生命医科学研究所の七野成之助教、松島綱治教授、静岡社会健康医学大学院大学の木下和生教授、自治医科大学環境予防医学講座の市原佐保子教授らの研究グループは、職業性胆管がんの原因物質である1,2-ジクロロプロパン(DCP)による発がん過程を解明するべく、胆管細胞と免疫細胞であるマクロファージを共培養し、DCP曝露により発現が変化した遺伝子群を網羅的に解析しました。その結果、胆管細胞では、DNA修復に関与する遺伝子群の発現が上昇し、マクロファージでは、細胞周期に関与する遺伝子群の発現が上昇することを突き止めました。本研究では、マクロファージと共培養することにより、生体内での炎症環境をin vitroで再現しています。本実験系を利用することにより、未知の発がん物質を検出することができ、新しい職業がんの発生を未然に防ぐことが可能となります。
2013年、ある印刷工場で胆管がんが多発していることが報告され、その原因物質として、DCPが特定されました。塩素系有機溶剤であるDCPは、工場内でインクの洗浄剤として大量に使用されており、当時はその発がん性については認知されていませんでした。DCP曝露による胆管がん発症は、がん周囲の組織に炎症性の変化が見られるなど一般的な胆管がんとは異なる発がん過程を示します。しかし、その発症機序はいまだ解明されていません。
研究グループが以前行った研究から、DCPは、単培養したときには胆管細胞にDNA損傷を起こさず、マクロファージと共培養したときのみ胆管細胞にDNA損傷を起こすことがわかっていました。そこで、本研究では、胆管細胞とマクロファージを共培養し、これをDCPに曝露するという実験系を構築し、DCP曝露後に各細胞から得られたトランスクリプトーム(*1)を解析して曝露の有無で発現に変化があった遺伝子を特定しました。
この解析から、DCP曝露によって、胆管細胞ではDNA修復に関与する遺伝子群の発現が、マクロファージでは細胞周期に関与する遺伝子群の発現が誘導されることがわかりました。本研究の実験系を利用することで、これまで見逃されてきた新しい発がん物質を検出することができ、新しい職業がんの発生を未然に防ぐことが可能となります。
本研究成果は、2022年7月3日に国際学術誌「Scientific Reports」にオンライン掲載されました。
研究の背景
DCPは、報告が多発するまでその発がん性が認知されておらず、法規制の対象外となっていました。このような化学物質が職業がんを引き起こしたことから、各事業者に「自律的な化学物質管理」を求める現在の労働安全衛生法改正の議論が起こりました。DCPは直接的にはDNA損傷を起こしません。このような未知の発がん性物質によるさらなる職業がんの発生を防ぐため、DCPによる胆管がん発症のメカニズムを明らかにし、未知の発がん物質を検出する方法を見出す必要があると研究グループは考えました。
研究グループが以前行った研究から、DCPは、マクロファージと共培養した胆管細胞では、DNA損傷のほかにも、AID発現(*2)、LDH細胞毒性(*3)、活性酸素種産生を起こすことが明らかになりました。本研究では、さらにそれらメカニズムを明らかにするため、DCP曝露によって胆管細胞およびマクロファージで起こる遺伝子の発現変化を調べました。
研究結果の詳細
ヒト胆管細胞(MMNK-1細胞)とヒトマクロファージ(THP-1細胞)を培養容器内で共培養し、0、0.1、0.4mM濃度のDCPに24時間曝露しました。この濃度は、工場内で従業員が曝露されていた濃度と同程度のものです。曝露後、各細胞を溶解バッファーに溶解し、細胞溶解液中に含まれるRNAを逆転写(*4)することにより、cDNAを得ました。このcDNAを転写プロファイルとして、トランスクリプトーム解析を行いました。すると、DCP曝露により発現が変動した遺伝子が、胆管細胞およびマクロファージにおいて、それぞれ1052個、1525個確認されました。
また、得られた転写プロファイルに含まれる遺伝子の機能を調べるため、データベースであるGO(Gene Ontology)およびKEGG(Kyoto Encyclopedia of Genes and Genomes)パスウェイを用いて、エンリッチメント解析を行いました。これにより、得られた試料中にどのような遺伝子が多く含まれている(=濃縮されている)かがわかります。
すると、胆管細胞から得られた転写プロファイルには、「塩基除去修復」に関連する遺伝子が濃縮されており、特にLIG1、PARP4、POLD1遺伝子が過剰発現していました。塩基除去修復は、DNA修復機構の一つです。がん発生は、がん遺伝子やがん抑制遺伝子のDNA損傷から開始されます。そのため、DNA修復関連遺伝子の発現は、DCP曝露によるDNA損傷の増加を示唆しており、これは先の研究結果とも一致します。
一方、マクロファージでは、「細胞周期」(*5)に関連する遺伝子が濃縮されており、特にBUBIB、CCNB2、CDC20、CDC45、CDK1、CDC7、MCM3、PLK1、PTTG1遺伝子が過剰発現していました。これらの遺伝子の多くは、細胞周期のG1期からS期、G2期からM期への進行、そして安定的な細胞増殖に寄与するものであるため、DCP曝露によってマクロファージの増殖が誘導される可能性が示唆されます。マクロファージは炎症反応の制御に主要な役割を担っており、DCP曝露後の損傷部位におけるマクロファージの蓄積は、炎症反応、発がんおよび腫瘍微小環境に影響を及ぼすと考えられます。
さらに、サイトカイン関連遺伝子およびその受容体遺伝子の発現レベルを調べました。マクロファージは免疫細胞として生体防御にはたらきます。その際には、サイトカインと総称される化学物質を放出して、他の細胞との情報伝達を行います。すると、マクロファージでは、DCP曝露により5個の遺伝子(TNFAIP8L1、CCL2、CXCL2、CX3CR1、CCR6)で発現変化に有意差が認められました。一方、胆管細胞では、各種サイトカイン、受容体の発現に変化はありませんでした。これにより、DCP曝露によってマクロファージでは炎症反応が誘導される一方、胆管細胞では誘導されないことがわかりました。
一般に、マクロファージは活性化することにより、異物や組織損傷に対する免疫・炎症反応を制御します。毒物・異物への反復曝露は、マクロファージによるサイトカイン産生を持続させ、炎症を増強させることにより、様々な病的状態やがんを引き起こす可能性があります。胆管細胞のDNA損傷につながる、胆管細胞とマクロファージの相互作用の解明が必要と考えられます。
本研究について、市原教授は、「DCPのように、細胞DNAへの直接的な損傷作用が小さい物質であっても、免疫細胞を介してDNA損傷を引き起こすことがあり、本研究が用いた実験系を利用することで、これまでに見逃されてきた発がん物質を検出し、新しい職業がんの発生を未然に防ぐことが可能となるでしょう」と述べ、さらなる発症機序の解明と今後の発展に意欲を示しています。
※本研究は、日本学術振興会科研費の新学術領域研究(17H06396)の助成を受けて実施したものです。
用語
*1 トランスクリプトーム
ある時点で細胞内に存在する遺伝子転写産物(mRNA)の総体をトランスクリプトームと呼ぶ。一般に、DNA上に保存された遺伝子は、mRNAに転写され、タンパク質に翻訳されることで機能するが、トランスクリプトーム解析では、ある刺激を与えた際に細胞内での発現が変化したmRNAを調べることにより、その刺激に応答してはたらく遺伝子を特定する。
*2 AID(Activation-induced cytidine deaminase)発現
抗体遺伝子の変異導入に寄与する酵素であり、がん遺伝子の突然変異にも関与する。
*3 LDH(Lactate dehydrogenase)細胞毒性
細胞膜に損傷を受けるとLDHが放出されることを利用し、物質の毒性を評価する。
*4 逆転写
通常の転写ではDNAからmRNAが合成される。mRNAは分解されやすいため、逆転写酵素を用いて、より安定なcDNAを合成する。
*5 細胞周期
細胞は、G1期(DNA合成準備期)、S期(DNA合成期)、G2期(分裂準備期)、M期(分裂期)をくり返し、細胞分裂を行う。
論文情報
雑誌名
Scientific Reports
論文タイトル
Transcriptome analysis of human cholangiocytes exposed to carcinogenic 1,2-dichloropopane in the presence of macrophages in vitro
著者
Abigail Ekuban, Shigeyuki Shichino, Cai Zong, Frederick Adams Ekuban, Kazuo Kinoshita, Sahoko Ichihara, Kouji Matsushima, Gaku Ichihara
DOI
研究室
東京理科大学について
東京理科大学:https://www.tus.ac.jp/
詳しくはこちら
