ニュース&イベント NEWS & EVENTS
タンパク質合成場であるリボソームの起源と進化
~原始tRNAと原始リボソームからのペプチドの生成~
研究の要旨とポイント
- タンパク質合成の場であるリボソームはタンパク質とRNAの複合体であり、23S rRNA上に位置するペプチジルトランスフェラーゼセンター(PTC)は二つのtRNAに似た構造様式で、対称的に配置されており、アミノ酸をつなげるペプチド結合生成に寄与します。
- 今回、PTCの構成要素である、たった74ヌクレオチドからなるRNAが二量体を形成し、アミノ酸を付加したミニヘリックス(原始tRNAのモデル)間でペプチド結合を生成させることを示しました。また、PTC構造を形成するtRNA様構造は、アミノ酸を付加したミニヘリックスのペプチド結合形成のための足場として生じた可能性も明らかになりました。
- さらに、ミニヘリックス状構造のRNAが、起源を同じくして、一方で現在のリボソームのPTCを構成するように進化し、もう一方で現在のtRNAとして機能するように進化した道筋も示しました。
- これは、地球上の生命システムの根幹を成すリボソームがどのようにして生まれ、現在の形に進化してきたのかという本質的な問いに対して、現在の生物に残された重要な手がかりを発見した極めて重要な成果です。
タンパク質合成の場であるリボソームはタンパク質とRNAの複合体です。アミノ酸をつなげるペプチド結合生成に寄与するペプチジルトランスフェラーゼセンター(PTC)は、約3000ヌクレオチドの長さを持つ23S rRNA上に、二つのtRNAに似た構造様式で、対称的に配置されています。
東京理科大学先進工学部生命システム工学科の田村浩二教授らの研究グループは、PTCの構成要素である、たった74ヌクレオチドからなるRNAが二量体を形成し、アミノ酸を付加したミニヘリックス(原始tRNAのモデル)間でペプチド結合を生成させることを証明しました。この反応は、二量体RNAの存在と、ミニヘリックスの3’末端に存在するCCA配列との相補性の両方に依存していました。これらの結果から、PTC構造を形成するtRNA様構造は、アミノ酸を付加したミニヘリックスのペプチド結合形成のための足場として生じた可能性が明らかになりました。さらに、ミニヘリックス状構造のRNAが、起源を同じくして、一方で現在のリボソームのPTCを構成するように進化し、もう一方で現在のtRNAとして機能するように進化した道筋を示し、現在のタンパク質合成系の形態のありようについても重要な光を投げかけました。
本研究成果は、2022年4月12日に国際学術誌「Life」にオンライン掲載されました。
研究の背景
DNAの塩基の配列に刻まれた情報の解読は、メッセンジャーRNA(mRNA)の三つの連続した塩基(コドン)で指定されたアミノ酸がリボソーム上で順次結合し、最終的にタンパク質が生成されることによって完遂されます。リボソームは50種以上のタンパク質と少なくとも3種類のRNAから構成される超複合体です。こうして20種類の側鎖を持つタンパク質が生成され、その化学的、構造的多様性により、生命活動に欠かせない多岐にわたる機能を果たしています。
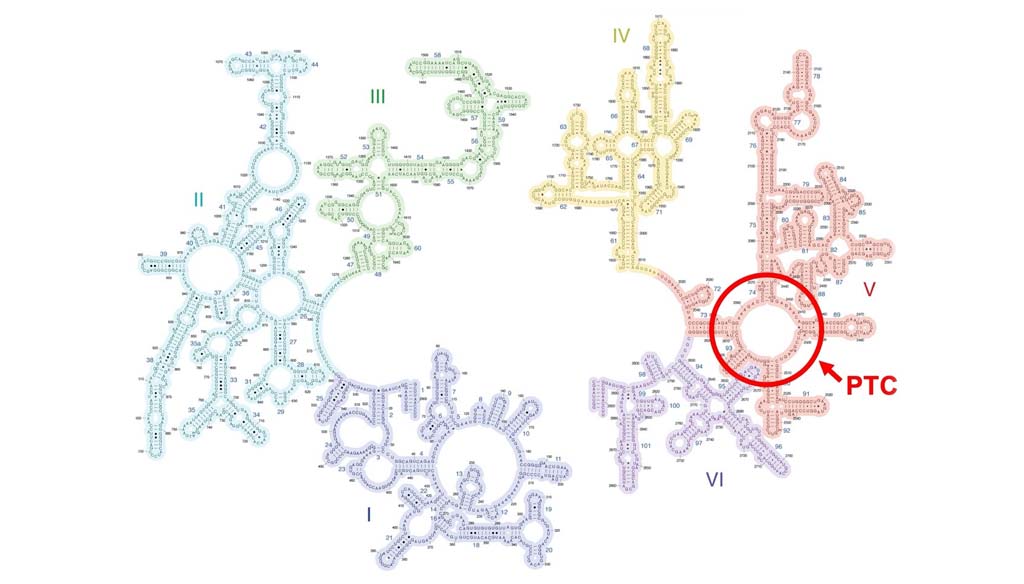
リボソームは大小二つのサブユニットから構成されており、それぞれ異なる役割を担っています。リボソームの大サブユニット中のペプチジルトランスフェラーゼセンター(Peptidyl Transferase Center、PTC)という場所で、ペプチド結合は生成されます。PTCは、約3000ヌクレオチド(RNAの構成単位)の長さを持つ23S リボソームRNA(rRNA)分子上に形成されています(図1)。
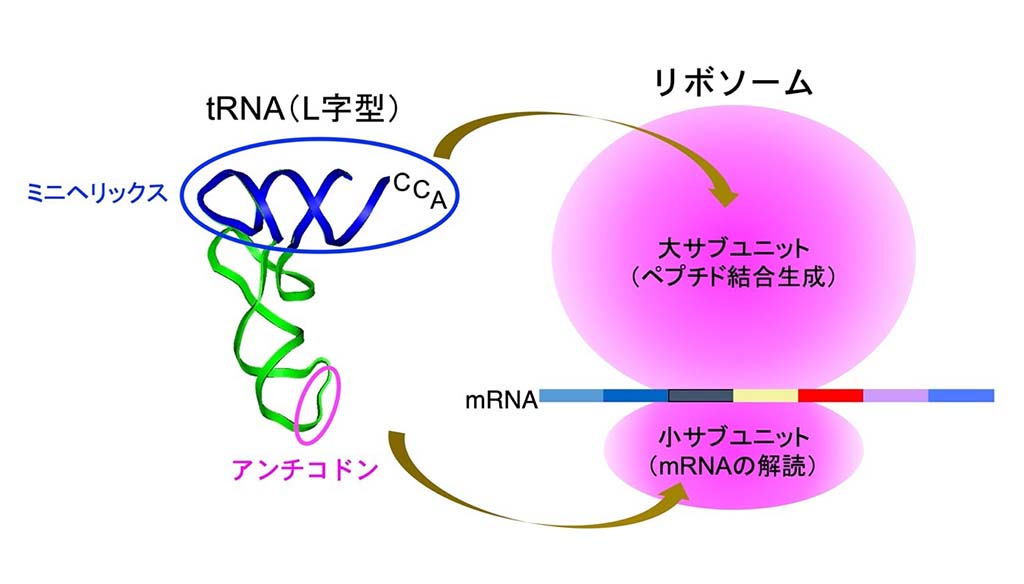
リボソームにはアミノ酸が付加されたトランスファーRNA(tRNA)が、mRNAの情報に従って運ばれてきます。その際、L字型の構造を持つtRNAの片方の腕に相当するアミノ酸結合部位のCCAを含む部分(ミニヘリックス)がリボソームの大サブユニットと相互作用し、L字型のもう一方の腕に相当するアンチコドンを含む部分がmRNAと相互作用することで、遺伝情報の正確性が保持されます(図2)。大サブユニットで起こるペプチド結合の生成は、アミノ酸の特異性に関わらず起こり、進化の観点からも、大サブユニットは小サブユニットに先んじて生成されたと考えられています。
しかしながら、原始地球上で、23S rRNAのような長さのRNAがどのようにして誕生し、どのようにしてタンパク質合成を行い始め、現在のリボソームに見られるタンパク質合成機構にまで進化してきたのかは未解明のままでした。
研究結果の詳細
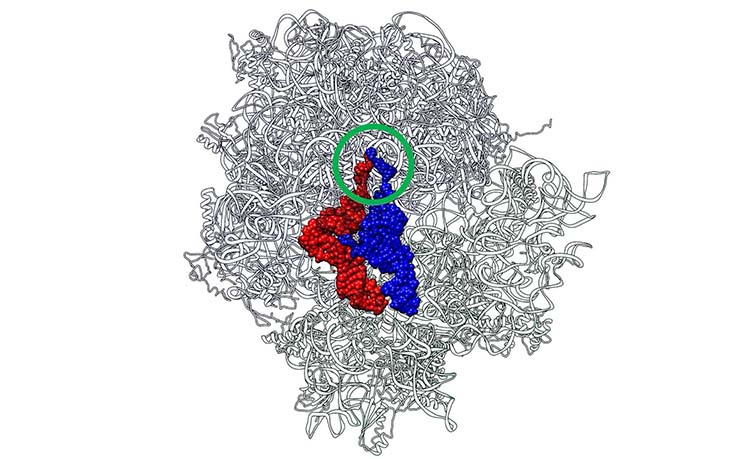
ペプチド結合が生成されるためには、アミノ酸を付加した二分子のtRNAの3’末端のCCA配列がリボソーム上で近接して配置される必要があります。したがって、生物学的進化の連続性の観点から、二分子のtRNAの近接性を担保する足場となるべきRNAの実体がどのように生まれたのかを明らかにすることが重要です。リボソームとtRNAとの複合体の立体構造を見ると、tRNAのCCA配列間の角度は約40°であり(図3)、ラグビーの五郎丸歩選手のルーティーン(「五郎丸ポーズ」)時の人差し指の形に実によく似た構造です。
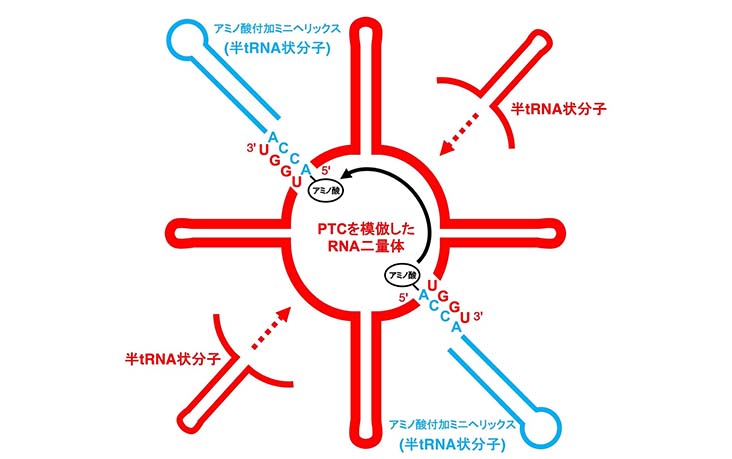
田村教授らは、放射線抵抗細菌Deinococcus radioduransのリボソームの大サブユニットの構造において、tRNAに似たL字型RNAが対照的に配置されてPTCを構成していることに注目し、この部分の構成成分であるRNAを足場として、アミノ酸を付加したミニヘリックス(原始tRNAのモデル)間でのペプチド結合生成を試みました。そして、エレクトロスプレーイオン化質量分析法を用いた解析から、たった74ヌクレオチドからなるRNA分子を足場として、ペプチド結合が生成されることを明らかにしました(図4)。
さらに、L字型を有するtRNA状の分子が、原始リボソームのPTCを構成し、また、ミニへリックスのような半tRNA状分子が重複して、初期のtRNA様分子を生成した可能性を指摘しました。つまり、ミニヘリックス状構造のRNAが、起源を同じくして、一方で現在のリボソームのPTCを構成するように進化し、もう一方で現在のtRNAとして機能するように進化したという道筋を示しました(図4)。なお、2009年のノーベル化学賞受賞者のAda Yonath博士のグループが、同様のPTCを構成するRNAが、化学的に活性化された人工モデル分子基質に対して、ペプチド結合生成を触媒することを、ごく最近報告しましたが、これらの分子は、田村教授らのグループとは違い、現在のタンパク質合成に使用されているtRNA状分子ではありませんでした。
今後の展望
本研究は、地球上の生命システムの根幹を成すリボソームがどのようにして生まれ、現在の形に進化してきたのかという本質的な問いに対して、現在の生物に残された重要な手がかりを発見した極めて重要な成果です。tRNAとrRNAに相同性があるという知見に基づくと、tRNA二量体もリボソームの原始形態であった可能性があります。一方、DNAやRNA などの成分であるプリンやピリミジンは、それぞれ、グリシンとアスパラギン酸というアミノ酸から合成されるという、生合成過程でのパラドックスに直面することを考慮すると、RNAの前駆体としての可能性として、例えば、ペプチド核酸(PNA)などが考えられるかもしれません。
本研究は、東京理科大学先進工学部生命システム工学科だけの成果ではなく、電子システム工学科の安藤格士准教授との共同研究でもあります。分野の垣根を超えた新しい視点が、研究推進の原動力になったことは、強調すべき点の一つです。リボソーム上でのペプチド結合生成は、タンパク質合成の鍵となる反応であり、今後、本研究を基盤とした新しいタンパク質工学・核酸工学への未知の展開が期待できます。
※ 本研究は、日本学術振興会科学研究費補助金(17K19210, 21K06293, 19K16204)の助成を受けて実施したものです。
論文情報
雑誌名
Life
論文タイトル
Peptide bond formation between aminoacyl-minihelices by a scaffold derived from the peptidyl transferase center
著者
Mai Kawabata, Kentaro Kawashima, Hiromi Mutsuro-Aoki, Tadashi Ando, Takuya Umehara and Koji Tamura
DOI
研究室
田村研究室のページ:https://kojitamura.web.fc2.com/icec_ioaaue.html/
田村教授のページ:https://www.tus.ac.jp/academics/teacher/p/index.php?4D37
安藤准教授のページ:https://www.tus.ac.jp/academics/teacher/p/index.php?31BA
東京理科大学について
東京理科大学:https://www.tus.ac.jp/
詳しくはこちら
