ニュース&イベント NEWS & EVENTS
オピオイドδ受容体作動薬の作用機序を解明!新規向精神薬としての応用へ前進
~グルタミン酸による神経伝達を抑制し、神経細胞自体の興奮も抑制する~
研究の要旨とポイント
- オピオイドδ受容体作動薬KNT-127は抗うつ様・抗不安様作用を持ち、既存の抗不安薬で報告されている記憶障害や消化器症状などの副作用を示さないことから、新規向精神薬として期待されていますが、詳しい作用機序はこれまで未解明でした。
- 本研究では、KNT-127が内側前頭前野の神経細胞に存在するオピオイドδ受容体に作用すると、神経細胞同士の情報伝達の場(シナプス)で、興奮性の神経伝達物質であるグルタミン酸の放出が減少して脳活動が弱まり、かつ神経細胞自体も興奮しにくくなることがわかりました。
- これは、既存の薬剤とは異なる新たな作用機序であることから、KNT-127は有望な創薬ターゲットであることが裏付けられ、新たな向精神薬の開発へ向けてまた一歩前進しました。
東京理科大学薬学部薬学科の斎藤顕宜教授、山田大輔助教らの研究グループは、これまでの研究からオピオイドδ受容体作動薬KNT-127が抗うつ様・抗不安様作用を示すことを突き止めており、新たな向精神薬候補として期待されていますが、その作用機序はわかっていませんでした。本研究で斎藤教授らは、神経細胞同士の情報のやりとりを単一細胞レベルで観察し、オピオイドδ受容体作動薬KNT-127投与により、マウスの内側前頭前野(mPFC)前辺縁領域 (PL-PFC)において、神経細胞同士の伝達の場(つまりシナプス)において、興奮性の神経伝達物質であるグルタミン酸の放出が減少して脳活動が弱まること、また、神経細胞自体も興奮しにくくなることを明らかにしました。これは、既存薬とは全く異なる作用機序です。
現在、うつ病や不安症の治療薬にはセロトニン再取り込み阻害薬(SSRI)やベンゾジアゼピン系薬物が処方されていますが、十分な効果が得られない患者さんも多く、治療満足度は高いとは言えない状況が続いています。そのため、既存薬とは異なる作用機序を持つ新規治療薬の開発が望まれています。
KNT-127は、げっ歯類のうつ病モデルにおいて、オピオイドδ受容体(DOP)作動薬として強力かつ迅速に不安を和らげる効果を示すことがすでにわかっています。また、KNT-127は、既存の抗不安薬で知られている記憶障害や消化器症状などの副作用を示さないため、新規向精神薬としての開発が期待され、そのメカニズムの解明に注目が集まっていました。
今回の研究で、これまで議論の的になっていたKNT-127の作用機序の鍵となるメカニズムが解明されました。今後、本研究成果を基盤として、オピオイドδ受容体をターゲットとした新たな抗精神薬の開発につながると期待されます。
本研究成果は、2021年5月14日に国際学術雑誌「Biochemical and Biophysical Research Communications」にオンライン掲載されました。
研究の背景
mPFCは、情動の処理において非常に重要な役割を果たす部位です。その中でもPL-PFCにおけるグルタミン酸作動性伝達の活性化は、げっ歯類において不安様行動を誘発することが知られています。
研究グループは以前の研究で、KNT-127の局所灌流が、PL-PFCにおいてベラトリン(※1)で誘発される細胞外グルタミン酸の上昇およびマウスにおける不安様行動を弱めることを報告しています。これはKNT-127がPL-PFCにおいてプレシナプス(※2)からのグルタミン酸の放出を抑制しているということを示唆する結果ですが、その直接的な証拠はまだ得られていませんでした。
今回、研究グループは、これまでの研究から示唆された、KNT-127がPL-PFCのプレシナプスからのグルタミン酸放出を抑制するというメカニズムを実験的に証明するために、ホールセルパッチクランプ法(※3)を用いて、細胞膜を流れるイオン電流を単一細胞レベルで記録しました。プレシナプスから放出されたグルタミン酸がポストシナプス(※4)の受容体に結合すると、Na+イオンが細胞内に流れ込み膜電位が脱分極し、細胞は興奮します。主にNa+イオンの流れによって生じるこの電流は興奮性シナプス後電流(EPSC)と呼ばれ、薬剤による影響を検討する際、その作用がプレシナプスの伝達物質放出によるものか、ポストシナプスの受容体感受性によるものかを知るための重要な手がかりとなります。
研究結果の詳細
研究グループは、摘出されたマウスの脳を人工脳脊髄液に浸し、PL-PFCを含む脳の冠状断面の生切片を作製し、ホールセルパッチクランプ法にて神経細胞のシナプス応答の電流測定を行いました。まず、脳切片を人工脳脊髄液に浸し、自発性興奮性シナプス後電流(sEPSC)を、また人工脳脊髄液にテトロドトキシンを加えて投与した際の自発性の微小興奮性シナプス後電流(mEPSC)を測定しました。さらに人工脳脊髄液にDOP拮抗薬のナルトリンドール(NTI)を加え、その中で脳切片をプレインキュベーションすることで、DOPを介したシグナル伝達への影響を阻害しました。それらの処置に併せてKNT-127投与を行い、投与前後のsEPSCとmEPSC、さらに興奮性シナプス応答のペアパルス比の分析を行いました。
KNT-127がPL-PFCのグルタミン酸作動性シナプスでの伝達物質放出を変化させるかどうかを調べるために、まず、マウスPL-PFCの主要ニューロンのsEPSCに対するKNT-127の効果を調べました。sEPSCの発生頻度は、KNT-127の非投与下で記録されたものと比較して、KNT-127の投与によって有意に減少しました。sEPSCの振幅、立ち上がり時間、減衰時間はKNT-127の影響を受けませんでした。mEPSCの平均発生頻度は、sEPSCと同様KNT-127の投与により有意に減少しました。一方NTIでプレインキュベーションした場合、mEPSCの発生頻度に対するKNT-127の効果は検出されませんでした。
これらの結果から、KNT-127の投与によってPL-PFCのDOPを介してプレシナプスからのグルタミン酸放出が抑制されたことが示されました(図)。また、ペアパルス比分析からも、KNT-127がPL-PFCのDOPを介してプレシナプスからのグルタミン酸の放出率を低下させるというメカニズムを支持する結果が得られました。PL-PFCニューロンの基本的な特性(活動電位発火および膜特性)に対するKNT-127の影響を調べた結果からは、KNT-127がマウスPL-PFCのニューロンの細胞膜興奮性を低下させる可能性が示唆されました。
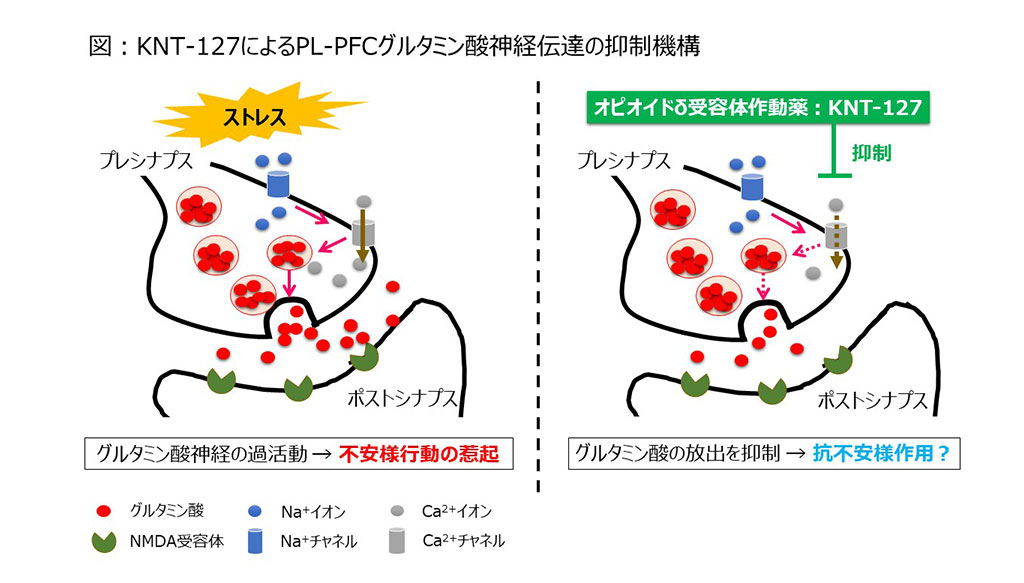
本研究から、KNT-127がマウスPL-PFCのプレシナプスからの伝達物質放出とポストシナプスのニューロン興奮性の低下を引き起こしたことが示唆されました。KNT-127の作用機序として、情動行動の制御に関連する領域であるPL-PFCにおけるニューロンの興奮性を低下させ、不安様行動を軽減するメカニズムを明らかになったことで、KNT-127の新規向精神薬の開発への応用に向けての研究が加速することが期待されます。
今回の成果について斎藤教授は、「現在、うつ病や不安症の治療薬にはセロトニン再取り込み阻害薬(SSRI)やベンゾジアゼピン系薬物が処方されていますが、十分な効果が得られない患者さんも多く、その治療満足度は高いとはいえない状況が続いています。このことから、既存薬とは異なる作用機序を持った新規治療薬の開発が望まれています。本研究の成果は、オピオイドδ受容体をターゲットするという、これまでにない新しい作用機序をもったEvidence-basedな(根拠に基づく)抗精神薬の開発につながると期待されます」として、今後の研究開発への期待を示しています。
※ 本研究は、国立研究開発法人日本医療研究開発機構(AMED)医療研究開発革新基盤創成事業(CiCLE)「オピオイドδ受容体活性化を機序とする画期的情動調節薬の開発」および日本学術振興会の科学研究費 基盤研究(C)17K10286、20K06930の助成を受けて実施したものです。
用語解説
※1 ベラトリン
メキシコ原産のユリ科植物の一種 Veratrum salbadillaの種子より抽出されたアルカロイドの混合物。Na+チャンネルを活性化させることで細胞外グルタミン酸の放出を誘発する。
※2 プレシナプス
シナプスの中で、グルタミン酸などの神経伝達物質を含む部位。軸索側に位置する。
※3 ホールセルパッチクランプ法
細胞膜に微小なガラス電極を密着させ、吸引することでガラス電極が付着している部分の細胞に穴を開け、全細胞の細胞膜を流れるイオン電流を記録する方法。
※4 ポストシナプス
シナプスの中で、グルタミン酸などの神経伝達物質を受け取る受容体が配置されている部位。樹状突起側に位置する。
論文情報
雑誌名
Biochemical and Biophysical Research Communications
論文タイトル
Modulation of glutamatergic synaptic transmission and neuronal excitability in the prelimbic medial prefrontal cortex via delta-opioid receptors in mice
著者
Daisuke Yamada, Junpei Takahashi, Keita Iio, Hiroshi Nagase, Akiyoshi Saitoh
DOI
斎藤研究室
研究室のページ:https://yakurisaitohlab.jimdofree.com/
斎藤教授のページ:https://www.tus.ac.jp/academics/teacher/p/index.php?7017
山田助教のページ:https://www.tus.ac.jp/academics/teacher/p/index.php?703E
