ニュース&イベント NEWS & EVENTS
アクリルアミドによる神経障害を防御する因子を解明
~ Nrf2による抗酸化または炎症に関わる遺伝子群の発現調節が鍵~
研究の要旨とポイント
- アクリルアミドは神経毒性、発がん性を持つことで知られる親電子性物質で、工業用途で用いられるだけでなく、食品にも含まれますが、神経障害を引き起こす詳細なメカニズムはまだわかっていませんでした。
- 本研究では、Nrf2がアクリルアミドによる神経障害を防御する役割を持ち、その防御機能の背景には、Nrf2の抗酸化ストレス遺伝子および抗炎症遺伝子の発現誘導作用、そして炎症促進サイトカイン遺伝子の発現抑制作用が働いていることを明らかにしました。
- アクリルアミドと同様の性質をもつ親電子性物質は大気を含む環境中に多く存在し、疫学研究は大気汚染がアルツハイマー病、認知症の発症・進行と関係していることを示しています。本研究は認知症の環境要因の解明と認知症予防法の開発につながると期待されます。
東京理科大学薬学部薬学科の市原学教授、東北大学大学院医学系研究科医科学分野の山本雅之教授、弘前大学医学部医学科の伊東健教授、東京大学医学部健康総合学科の大迫誠一郎准教授、自治医科大学医学部環境予防医学講座の市原佐保子教授らは、Nrf2(nuclear factor erythroid 2-relatad factor 2)と呼ばれる生体防御に関連する転写因子がアクリルアミドによる神経障害を防御する役割を持つことを、マウスを用いた実験から示しました。アクリルアミドがヒトの中枢神経および末梢神経を障害するメカニズムが解明できれば、アクリルアミドによる神経障害の予防法の開発につながると期待されます。本研究成果は、2021年4月16日に国際学術誌「Toxicology」にオンライン掲載されました。
アクリルアミドは神経毒性、発がん性を持つことで知られる親電子物質ですが、工業用途で用いられるだけでなく、食品にも含まれます。これは、食品の加熱加工過程でアミノ酸の1種であるアスパラギンと、果糖、ブドウ糖などの還元糖がメイラード反応という化学反応を起こすことで、アクリルアミドが生じるためです。
Nrf2は、抗酸化ストレスおよび親電子物質によってもたらされるストレスを制御する転写因子です。しかしながら、環境親電子物質であるアクリルアミドによる神経障害を受ける際に、Nrf2がどのような役割を持つのかについてはあまりよくわかっていませんでした。
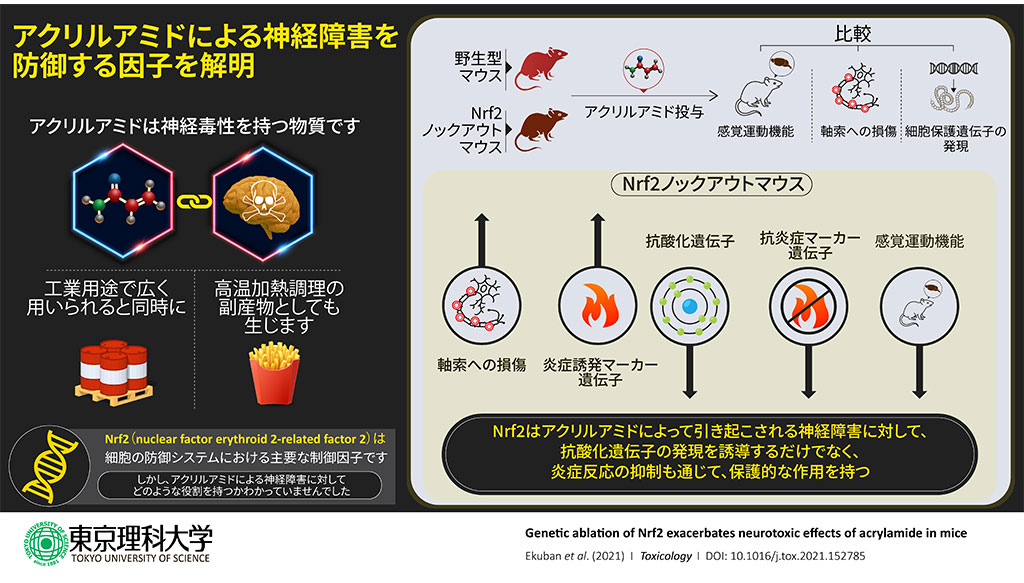
そこで研究グループはNrf2ノックアウトマウスと野生型マウスにアクリルアミドを4週間経口投与し、その影響を比較しました。その結果、Nrf2ノックアウトマウスの方が神経障害の程度が大きいこと、そして、抗酸化ストレス遺伝子と抗炎症遺伝子の発現は低い一方で、炎症を促進するサイトカイン遺伝子の発現は高いことが示されました。これは、Nrf2がアクリルアミドによる神経障害を防御する役割を持ち、その防御機能の背景には、Nrf2の抗酸化ストレス遺伝子および抗炎症遺伝子の発現誘導作用、そして炎症促進サイトカイン遺伝子の発現抑制作用が働いているということを示唆する結果です。
研究の背景
アクリルアミドは紙力増強剤や水処理剤などに用いられるポリアクリルアミドの原料として用いられる、環境親電子物質です。さらに、アクリルアミドは、メイラード反応によっても生じることから食品にも含まれます。アクリルアミドはヒトや実験動物に対する神経毒性を有することが知られており、中枢神経系および末梢神経に影響を与え、神経障害や脳症を引き起こします。ヒトの場合は、アクリルアミドに曝露されることで運動失調や骨格筋の脱力、認知障害などが引き起こされます。実験動物の場合は、アクリルアミドによって末梢神経軸索および中枢神経・末梢神経の神経末端が選択的に障害され、発がん性を示すと同時に発達と繁殖にも有害な影響を及ぼすことが知られています。アクリルアミドは親電子物質であることから、グルタチオンやタンパク質のスルフィドリル基と共有結合することで、細胞のさまざまな機能やプロセスに影響を与えます。アクリルアミドと同様の親電子性を有する1-ブロモプロパンはフロン代替溶剤として用いられ、米国、日本の労働者において重篤な神経障害を引き起こしました。
Nrf2は抗酸化反応の制御において主要な役割を果たす因子として知られていますが、近年の研究から、炎症誘発性サイトカインのプロモーター領域に結合し、転写活性化を抑制することが明らかになりました。これは、Nrf2が2つの細胞保護経路を制御するという重要な役割を担っていることを示しています。しかしながら、環境親電子物質であるアクリルアミドによる神経障害を受ける際に、Nrf2がどのような役割を持つのかについてはあまりよくわかっていませんでした。
研究結果の詳細
本研究では、10週齢のNrf2ノックアウトマウス(C57BL/6JJc)と野生型マウスを48個体ずつ準備し、それぞれを4つのグループに分け、飲水中に0ppm、67ppm、110ppm、200ppmのアクリルアミドを添加して4週間飼育し、アクリルアミドの影響を調べました。
まず、運動機能の評価試験であるlanding foot-spread testを行いました。landing foot-spread testは、地面から15cmの高さからマウスを落下させ、着地したときの後肢同士の距離を計測する試験で、後肢が離れていればいるほど運動機能が低いと判断されます。この試験の結果、Nrf2ノックアウトマウスではアクリルアミド曝露により着地時の後肢の距離は有意に大きくなり、その差は用量が増えるほど顕著になる一方、野生型マウスではそのような傾向はありませんでした。重回帰解析からアクリルアミドの投与量とNrf2遺伝子欠失は有意な交互作用があることも示され、遺伝子型がアクリルアミド曝露による影響を決定するということが示唆されました。
次に、免疫組織化学染色を行い、ノルアドレナリンおよびセロトニン(5-HT)作動性軸索と、ミクログリアの活性化に特徴的なIba-1陽性ミクログリアの前頭前皮質における分布を調べました。ノルアドレナリンやセロトニン(5-HT)などのモノアミンは中枢神経系および末梢神経においてさまざまな生理学的機能や恒常性の維持に関わっており、神経毒の重要な標的となります。
その結果、前頭葉皮質のノルアドレナリン作動性軸索の密度は、Nrf2ノックアウトマウスおよび野生型マウスの両方で、アクリルアミド投与用量依存的に減少しましたが、同じ用量を投与したマウス同士を比較すると、野生型よりもNrf2ノックアウトマウスの方がノルアドレナリン作動性軸索の密度の減少が著しく、Nrf2ノックアウトマウスの方がアクリルアミドの神経毒性に対して感受性が高いことが示唆されました。セロトニン(5-HT)作動性軸索の密度も、同様の傾向を示しました。Iba-1陽性ミクログリアの面積および突起の長さは、Nrf2ノックアウトマウスおよび野生型マウスの両方で、アクリルアミド投与用量依存的に増加しましたが、Nrf2ノックアウトマウスでは200ppm群で特にミクログリアの面積と突起の長さが増加していたことから、Nrf2ノックアウトマウスにおいてミクログリアの活性が上昇していると示唆されました。
さらに、前頭葉皮質において、抗酸化物質、炎症反応の促進、抗炎症に関わる遺伝子のリアルタイム定量PCRを行いました。その結果、Nrf2遺伝子欠失は、抗炎症マーカー遺伝子群および抗酸化遺伝子群のmRNAアップレギュレーションを抑制する一方、アクリルアミドによって誘導される炎症誘発性サイトカインイン遺伝子群のmRNAのアップレギュレーションは増強することも示されました。具体的には、抗酸化遺伝子であるNAD(P)H:キノンオキシドレダクターゼ-1(NQO1)やスーパーオキシドディスムターゼ1(SOD1)、ヘムオキシゲナーゼ-1(HO-1)、抗炎症遺伝子であるアルキナーゼ-1(Arg1)、炎症性ゾーン-1(Fizz1)、キチナーゼ3様タンパク質3(Chi3l3)、インターロイキン-4 受容体アルファ(IL-4Rα)、CD206、トランスフォーミング増殖因子-β1(TGFβ1)のmRNAアップレギュレーションの抑制と、炎症誘発性サイトカインインであるインターロイキン-1 ベータ (IL-1β), tumor necrosis-alpha (TNF-α) and inducible nitric oxide synthase (iNOS)のmRNAのアップレギュレーションの増強が確認されました。
最近の疫学研究では、大気汚染とアルツハイマー病、認知症との関連性が示されています。大気汚染物質には粒子とともに、親電子性化学物質が含まれていることから、本研究がアルツハイマー病、認知症の予防に役立つ可能性があります。
※ 本研究は、日本学術振興会の化学研究費基盤研究(B)(16H02965、19H04279)、新学術領域研究(研究領域提案型)(17H06396)の助成を受けて実施したものです。
論文情報
雑誌名
Toxicology
論文タイトル
Genetic ablation of Nrf2 exacerbates neurotoxic effects of acrylamide in mice
著者
Frederick Adams Ekuban, Cai Zong, Madoka Takikawa, Kota Morikawa, Toshihiro Sakurai, Sahoko Ichihara, Ken Itoh, Masayuki Yamamoto, Seiichiroh Ohsako, Gaku Ichihara
DOI
市原研究室
研究室のページ:https://www.rs.tus.ac.jp/oeh/
市原教授のページ:https://www.tus.ac.jp/academics/teacher/p/index.php?6971
