ニュース&イベント NEWS & EVENTS
ウイルス由来のペプチドが細菌の生命必須の装置を止める仕組みを解明
〜薬剤耐性菌克服への重要な手掛かり〜
国立大学法人 奈良先端科学技術大学院大学
公益財団法人高輝度光科学研究センター
東京理科大学
発表のポイント
- 細菌の生存に必須な細胞壁の部品を輸送する細胞膜のタンパク質MurJに、細菌に感染するウイルス(バクテリオファージ)の小型溶菌ペプチドLysMが直接結合して固定し、輸送機能を阻害する仕組みを解明しました。
- クライオ電子顕微鏡 (cryo-EM)によってMurJとLysMの立体構造を決定し、LysMのMurJ阻害機構を分子レベルで解明しました。
- 強力な溶菌活性を持つLysMは、耐性菌や細菌種に応じた改変型LysMの開発など、新しい抗生物質開発に役立ちます。
研究の概要
奈良先端科学技術大学院大学(学長:塩﨑一裕)先端科学技術研究科バイオサイエンス領域構造生命科学研究室の塚崎智也教授、甲賀栄貴助教、博士後期課程学生(当時) ナパティップ・レプリーダコン、宮崎亮次助教らの研究グループは、高輝度光科学研究センターの重松秀樹主幹研究員、東京理科大学の森貴治准教授との共同研究により、細菌に感染するウイルス(バクテリオファージ、注1)が持つ超小型溶菌タンパク質LysMが、大腸菌の必須膜タンパク質MurJに直接結合し、その構造変化を阻害する仕組みを解明しました。
MurJは、細胞壁の部品である前駆体分子「リピドⅡ」を、細胞質から細胞質の外へ運ぶために欠かせない膜タンパク質であり、「内向き構造」と「外向き構造」を交互に繰り返す構造変化を利用して「リピドⅡ」を輸送します。一方、LysMはレビウイルスファージMの溶解遺伝子に由来するタンパク質で、わずか37個のアミノ酸残基からなる小さな膜タンパク質(ペプチド)です。LysMがMurJを阻害すると、細胞壁前駆体リピドⅡの輸送が止まり、細胞壁が作れない細菌は生存できなくなります。本研究では、クライオ電子顕微鏡(注2)を用いてMurJ–LysM複合体の立体構造を世界で初めて決定し、LysMが外向き型MurJの割れ目にくさび状に入り込み、MurJの構造変化を妨げる分子機構を明らかにしました。
本研究は、LysMの阻害機構を解明するとともに、抗菌薬開発に役立つ知見を得ました。特に、LysMの特異性を改変することで耐性菌を含む多様な病原性細菌にも作用させられる可能性があり、本研究の構造情報は新しい抗菌薬の開発へとつながります。
本研究の成果は、国際科学雑誌「Science Advances」に2025年10月8日(水)午後2時(ニューヨーク時間)に公開されました(DOI:10.1126/sciadv.ady8083)。
背景と目的
真正細菌は、細胞膜の外側に細胞の形を維持するための細胞壁を持っています。ペニシリンなど多くの抗生物質は、この細胞壁の合成を妨げることで効果を発揮します。細胞壁の合成には、細胞質でつくられる前駆体分子「Lipid Ⅱ(リピドⅡ)」が必要であり、MurJはこのリピドⅡを細胞膜の内側から外側へ運ぶために欠かせない膜タンパク質です。MurJは、細胞質側またはペリプラズム側に向かってV字型に開いた「内向き型」と「外向き型」の2つの状態を交互に繰り返すことで、リピドⅡを輸送します(図1)。
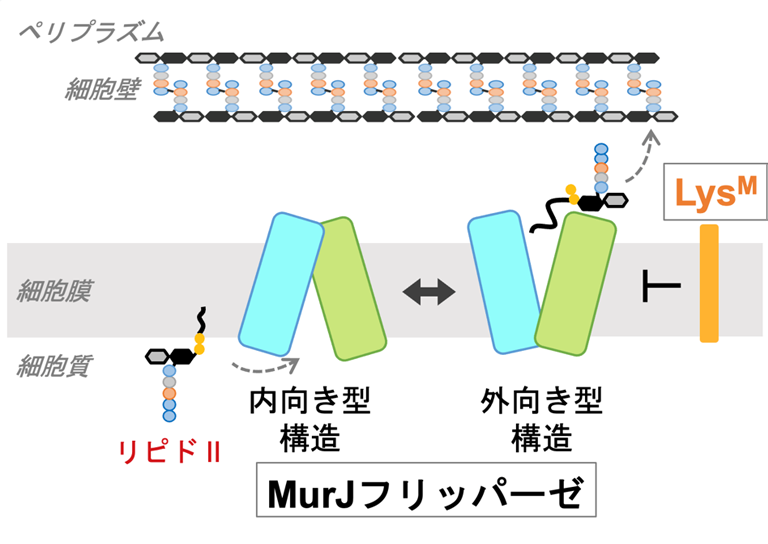
図1: MurJは、細胞質で合成された前駆体分子リピドⅡを、構造を「内向き型」と「外向き型」に切り替えることで膜の外側へ運ぶ。
一方、細菌に感染するウイルス(バクテリオファージ)の中には、宿主の細胞壁を破壊する小型タンパク質を持つものがあります。特に、LevivirusファージM由来の37アミノ酸からなるタンパク質LysM(別名 SglM)は、MurJを阻害して細胞壁前駆体リピドⅡの輸送を止め、細胞壁の合成を妨げることで細菌を溶菌させます。しかし、その詳細な阻害機構はこれまで不明でした。本研究では、クライオ電子顕微鏡(cryo-EM)による構造解析を中心に、LysMがMurJをどのように阻害し、リピドⅡの輸送を停止させるのかという分子メカニズムを解明することを目指しました。
研究の内容
本研究では、LysMがMurJにどのように結合し、その機能を阻害するのかを明らかにするために、MurJとLysMの立体構造解析を行いました。MurJとLysMの複合体(JM(ジャム)複合体: 詰まるという意味をこめてジャム複合体と読む)を精製し、クライオ電子顕微鏡により3.09Å分解能(注3)で複合体の立体構造を決定しました(図2)。得られた構造は、MurJが「外向き型」構造に固定された状態であり、その開口部にLysMがくさび状に結合している様子が可視化されました。LysMは二本のヘリックス(らせん構造)から構成され、膜内に深く埋まる部分と膜表面に沿って配置される部分を持つことが示されました。LysMがMurJの外向き型構造の割れ目にくさびのように入り込むことで、MurJが本来行うべき構造変化を物理的に妨げている様子が明らかになりました。
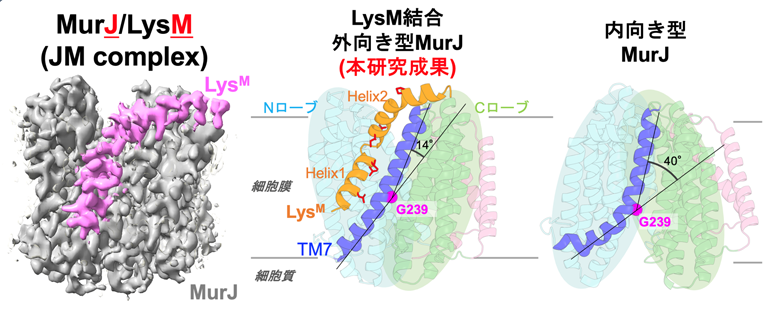
図2: MurJ/LysM(JM)複合体の立体構造
左:クライオ電子顕微鏡により得られたJM複合体の立体像、灰色はMurJ、マゼンタはLysMを示す。
中央: LysM結合MurJの外向き型構造。LysM(オレンジ)、機能に必須なアミノ酸は赤で示している。右:これまでに報告された内向き型構造。
さらにLysMのどの部分が機能に重要かを調べるため、変異体を用いた解析によってLysMの機能に不可欠なアミノ酸残基を同定しました。これらのアミノ酸残基は、構造解析においても直接的に接触する領域であることが確認されました。
また既知の構造との詳細な比較により、LysMは、MurJの構造変化に重要な領域(TM7)に相互作用することが明らかとなりました(図3)。つまり、TM7の構造変化はG239を中心に起きるが、LysMはG239付近に結合することでTM7を直線状に固定化することが判明したのです。LysMの結合は、MurJを外向き型構造に安定化させることが示されました。
一方、これまで報告されている内向き構造では、TM7はG239を中心に大きく折れ曲がっています。このLysMによる安定化は分子動力学計算によってもサポートされました。これらの結果を総合して、LysMはMurJの動きを固定化することでリピドⅡの輸送を停止させ、その結果、細胞壁合成を阻害し細菌の生存を妨げるという作用モデルを提案しました。
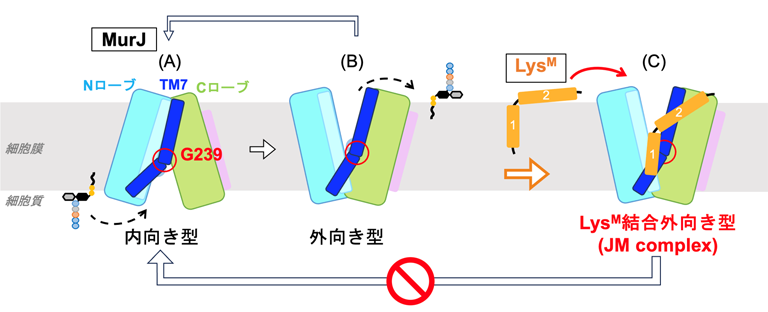
図3:LysMによるMurJの阻害モデル
(A)内向き型では、細胞質側からリピドⅡを取り込む。(B)外向き型ではペリプラズム側に開いてリピドⅡを放出する。その後、MurJは再び内向き型に戻り、輸送サイクルを繰り返す。
(C)LysMはMurJの外向き型に結合し、TM7に存在する残基の柔軟な動きを制限することで、MurJ構造変化が阻害される。
今後の展開
本研究により、LysMがMurJに結合してその動きを阻害する分子メカニズムが明らかになりました。この成果は、細菌が生きるために必須な膜輸送体の動作原理を理解するうえでも大きな意義を持つだけでなく、MurJを標的とする新しい抗菌薬の開発につながります。今後は、この作用メカニズムを基盤として、LysMの宿主特異性を改変し、耐性菌を含む多様な病原性細菌にも応用できるMurJ阻害型の創薬研究を進めていきたいと考えています。
用語解説
注1 バクテリオファージ:細菌に感染して増殖するウイルスの総称。細菌の中に入り込み、自身の複製とともに宿主細菌を破壊する性質を持つ。自然界には多様な種類が存在する。
注2 クライオ電子顕微鏡:タンパク質の構造解析に広く用いられている、試料を極低温に冷却し、電子顕微鏡で観察する手法。X線結晶構造解析では困難だった、結晶化が難しいタンパク質の構造解析に大きく貢献している。
注3 分解能:対象物の細部をどの程度まで識別できるかを示す指標。本稿での高い分解能とは、その値(単位はÅ)がより低いものを指し、それだけ細部まで識別可能になる。
掲載論文
タイトル
Phage lysis protein LysM acts as a wedge to block MurJ conformational changes
(ファージ溶菌タンパク質LysMは、MurJの構造変化をブロックするくさびとして機能する)
著者
Hidetaka Kohga, Napathip Lertpreedakorn, Ryoji Miyazaki, Sixian Wu, Kaito Hosoda, Hiroyuki Tanaka, Yutaro S. Takahashi, Kunihito Yoshikaie, Yutetsu Kuruma, Hideki Shigematsu, Takaharu Mori, and Tomoya Tsukazaki
(甲賀栄貴, Napathip Lertpreedakorn, 宮崎亮次, 呉思賢, 田中宏幸, 高橋祐太郎, 細田凱斗, 吉海江国仁, 車兪澈, 重松秀樹, 森貴治, 塚崎智也)
掲載誌
Science Advances
