ニュース&イベント NEWS & EVENTS
新型コロナワクチンに誘導される記憶T細胞集団がワクチン接種ごとに置き換わることを発見
~ヒト免疫応答の理解と新たなワクチン設計への重要な知見~
東京理科大学
奈良県立医科大学
研究の要旨とポイント
- 従来の免疫学では、初回ワクチン接種で誘導された記憶T細胞が新たなワクチン接種のたびに増殖することで、T細胞による免疫記憶を維持していると考えられてきました。
- 本研究では、新型コロナワクチンによって誘導される記憶T細胞は、ワクチン接種のたびに古い抗原特異的T細胞クローンの一部が増殖能力を失い、新たな抗原特異的T細胞のクローンに置き換わることで、記憶T細胞の多様性が維持されていることを明らかにしました。
- 本研究成果により、人体の免疫応答メカニズムがより深く理解され、新しい治療薬やワクチンの開発に対する貢献が期待されます。
研究の概要
東京理科大学 生命医科学研究所炎症・免疫難病制御部門の青木 寛泰研究員、上羽 悟史准教授、松島 綱治教授、奈良県立医科大学 免疫学講座の伊藤 利洋教授らの共同研究グループは、新型コロナワクチンで誘導される新型コロナに特異的なT細胞受容体(TCR)をもつT細胞クローンの応答を追跡し、ワクチンを接種するたびに古いT細胞クローンの一部が増殖能力を失い、新たに異なる特異的TCRを持ったT細胞クローンが増殖することを突き止めました。
2019年に世界中で流行した新型コロナウィルス(SARS-CoV-2)は、人類の感染症に対する認識を大きく変えました。開発された新型コロナワクチンは強力なT細胞応答を引き起こすことが知られていますが、その反応についてのクローン解像度の解析はこれまで行われていませんでした。そこで本研究では、新型コロナワクチンを3回接種した健常人の血液中に含まれるT細胞の応答を詳しく調査しました。
T細胞クローンを同定するTCRシーケンス解析とSARS-CoV-2特異的T細胞を検出するHLAテトラマー解析により、新型コロナワクチン接種後のT細胞のクローン応答を追跡しました。ワクチン後に有意に増殖したクローンを「responder」と定義してresponderの増殖パターンを分類すると、responderを構成するクローンは1回目の接種後に急速に増殖した「early responder」から2回目の接種後には「main responder」へと置き換わりました。さらに、3回目の接種後には「main responder」が再増殖しましたが、その多様性は減少し、「3rd responder」に部分的に置き換わることが明らかになりました。CD8+ T細胞クローンが主に反応するエピトープが入れ替わることや、同じエピトープを認識する集団内でも反応するクローンが入れ替わる現象も発見され、クローンが置き換わる際の応答パターンの多様性が示唆されました。このシステムは見かけ上不合理ですが、記憶T細胞数を維持しながらも、病原体の変異に柔軟に対応する多様性を維持していると考えられます。この研究結果を発展させることで、生体内防御反応に深い理解をもたらし、新たな疾患治療法や治療薬の開発へ貢献することが期待されます。
本研究成果は、2024年3月7日に国際学術誌「Cell Reports」にオンライン掲載されました。
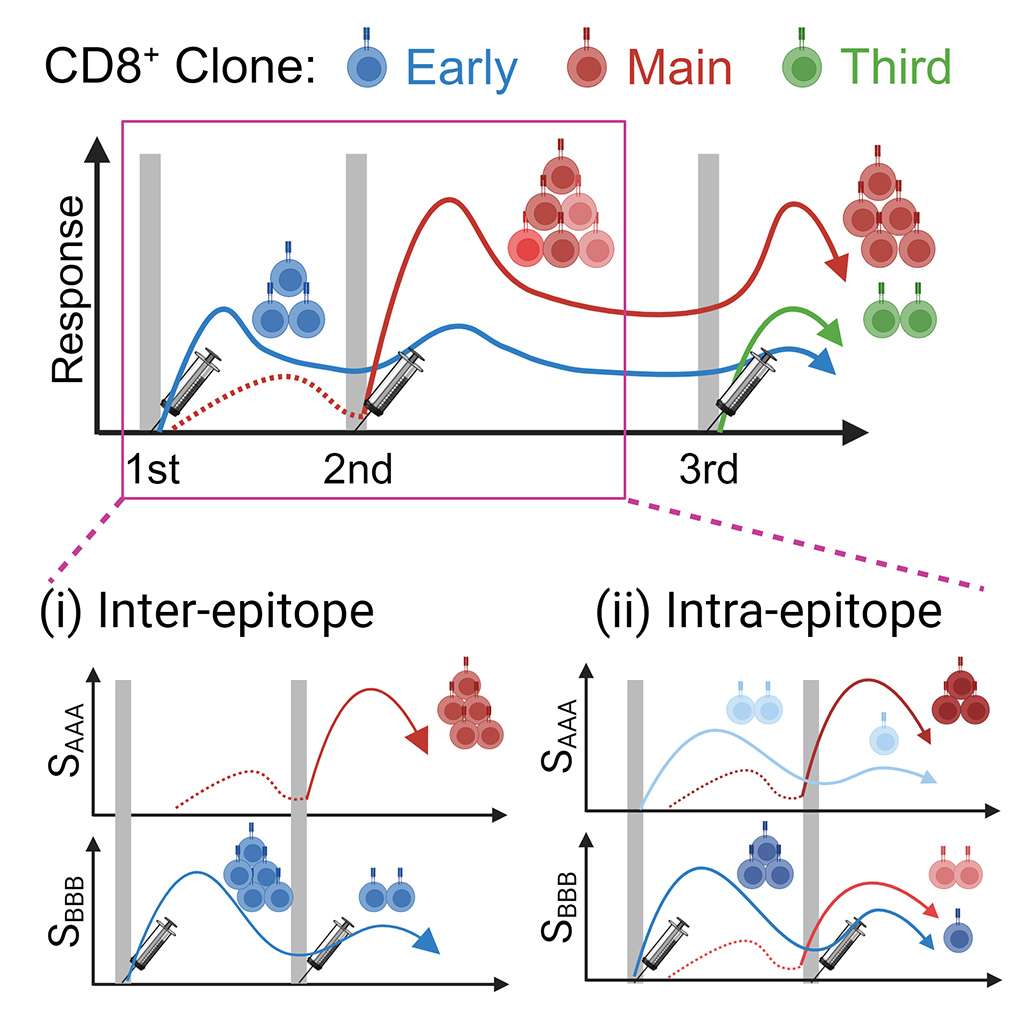
図上 ワクチン接種回数と各T細胞集団の応答の変化
図下 (i)エピトープ内での各T細胞集団の応答、(ii)エピトープ間での各T細胞集団の応答
研究の背景
新型コロナウィルス(SARS-CoV-2)のスパイクタンパク質に対するmRNAワクチンは、新型コロナウィルス感染症(COVID-19)に有効です。これらのmRNAワクチンは、ウィルスのスパイクタンパク質に特異的な液性免疫と細胞性免疫を誘発します。細胞性免疫応答には交差免疫があるため、液性免疫よりもSARS-CoV-2の変異型に対する防御効果が高い可能性があります。そのため、このような細胞性免疫応答をより正確に理解するためには、ウィルス感染細胞を認識して排除する特異的なCD8+ T細胞の応答を包括的に解析する必要があります。しかしながら、スパイクタンパク質に特異的なT細胞受容体(TCR)を持つクローン集団はCD8+ T細胞中のごく一部であり、mRNAワクチン接種で誘導されるスパイクタンパク質特異的なT細胞応答のクローン解像度での解析は行われてきませんでした。
本研究グループは、以前の研究で、同じ抗原を反復してマウスに接種し、抗原特異的なT細胞受容体を持つT細胞の応答を詳細に解析しました。その結果、初回の抗原接種で誘導された記憶T細胞は、2回目、3回目と回数を重ねるたびに増殖能力を失い、新しい抗原特異的T細胞集団に置き換わっていくことを見出していました。従来の免疫学では、抗原を認識して増殖したT細胞は記憶T細胞となり、同じ抗原を認識すると何度でも増殖して生体防御を担うと考えられていたため、この発見は定説を覆すものでした。T細胞の応答をクローン解像度で解析可能になった今日、ヒトにおいても同一クローンが永続的に応答できるのかを検証することができるようになりました。そこで、ヒトでもマウス同様の記憶T細胞集団の置き換わりが生じているかどうかを明らかにするため、今回は健常人の血液中に含まれるT細胞クローンの応答を追跡しました。
研究結果の詳細
ファイザー社の新型コロナワクチンBNT162b2を3回目まで接種した奈良県立医科大学の医療従事者38人を対象に調査を行い、参加者から1人あたり約10時点の末梢血単核球(PBMC)サンプルを採取しました。PBMCサンプルから分離したCD4+およびCD8+ T細胞に対し、次世代DNAシーケンサーを使ったTCRシーケンス解析、コロナウィルスが持つ特定のアミノ酸配列(エピトープ)に反応性を有するT細胞を検出するペプチド-HLAテトラマー解析を行いました。mRNAワクチン接種に対するT細胞応答を解析するため、各ワクチン接種後7日目に有意に増殖したクローンを「responder」として同定しました。
通常、新規抗原に対するT細胞の一次応答はナイーブT細胞によって媒介され、同じ抗原に対する二次応答よりも遅く、弱いことが知られています。1回目ワクチン接種後7日目にはナイーブT細胞による一次応答を検出することは難しいと想定されましたが、本研究では1回目の接種後7日目に急速に増殖した「early responder」が検出され、この「early responder」には風邪コロナウィルスに対する記憶T細胞が含まれることが示唆されました。また、2回目の接種後に増殖し、1回目の注射後には早期に増殖を示さなかった「main responder」、3回目の接種後にのみ出現し増殖した「3rd responder」も認めました。
ワクチン接種の都度クローンが置き換わるかを検証したところ、2回目のワクチン接種後、「main responder」の応答が「early responder」を大きく上回ることがわかりました。このとき、「main responder」は約16倍に増殖しましたが、「early responder」は約2倍にしか増殖しなかったことから、mRNAワクチン接種に反応するT細胞クローンが「early responder」から「main responder」に置き換わったことが示唆されました。3回目のワクチン接種後、「3rd responder」の増殖が観察されたものの、「main responder」は依然として優勢でした。一方で、3回目のワクチン接種後の「main responder」のクローンの多様性は減少し、新たに増殖した「3rd responder」の動員によって部分的に置換されることもわかりました。
また、mRNAワクチン接種による記憶T細胞クローンの置き換わりが、異なるエピトープ間(エピトープ間シフト)で起こるのか、一つのエピトープ内(エピトープ内シフト)で起こるのかを明らかにすることを試みました。解析の結果、エピトープ間で抗原特異的T細胞のクローンの増殖に有意差があることがわかりました。一方、「early responder」から「main responder」への置き換わりが同じエピトープ内で発生しており、これはエピトープ内シフトが生じていることを示唆しています。以上の結果から、新型コロナウィルスに応答するCD8+ T細胞クローンはそれぞれ特定のエピトープに反応しますが、クローンが置き換わる際には反応するエピトープが変化する場合と、同じエピトープに対して応答するクローンが変化する場合があることも突き止めました。
本研究を主導した上羽准教授は「今回の成果により、私たちが過去にマウスで見出した記憶T細胞集団の置き換わりがヒトでも起きていることがわかりました。従来の免疫記憶研究では、記憶細胞の機能と持続性に関わる分子機構に焦点があてられてきましたが、私たちは記憶T細胞クローンの置き換わりや新規動員を最適化し、集団としての多様性を維持することも重要と考えています。記憶T細胞の応答や多様性の維持機構を理解することで、感染症やがんなどに対してより効果的で持続的な免疫記憶を誘導する新しいワクチンの設計や改良に役立つ可能性があります。また、個人の免疫応答の特徴を理解することで、個人に適したワクチン戦略や治療法を提供できるかもしれません」とコメントしています。
※本研究は、日本学術振興会の科研費(17929397, 20281832, 22H05064, 23H02706)、日本医療研究開発機構(JP22fk0310509, JP22fk0310514, JP22ama221306, JP21gm6210025)による助成を受けて実施されました。
論文情報
雑誌名
Cell Reports
論文タイトル
CD8+ T-cell memory induced by successive SARS-CoV-2 mRNA vaccinations is characterized by shifts in clonal dominance
著者
Hiroyasu Aoki, Masahiro Kitabatake, Haruka Abe, Peng Xu, Mikiya Tsunoda, Shigeyuki Shichino, Atsushi Hara, Noriko Ouji-Sageshima, Chihiro Motozono, Toshihiro Ito, Kouji Matsushima, and Satoshi Ueha
DOI
発表者
- 青木 寛泰
- 東京理科大学 生命医科学研究所 炎症・免疫難病制御部門 研究員<筆頭著者>
- 北畠 正大
- 奈良県立医科大学 免疫学講座 講師
- 阿部 遥
- 東京理科大学 生命医科学研究所 炎症・免疫難病制御部門 技術員
- Peng Xu
- 東京理科大学大学院 生命科学研究科 博士後期課程3年
- 角田 樹也
- 東京理科大学大学院 生命科学研究科 博士後期課程2年
- 七野 成之
- 東京理科大学 生命医科学研究所 炎症・免疫難病制御部門 講師
- 原 篤志
- 奈良県立医科大学 免疫学講座 博士課程1年
- 王寺(下嶋) 典子
- 奈良県立医科大学 免疫学講座 助教
- 本園 千尋
- 熊本大学 ヒトレトロウイルス学共同研究センター 准教授
- 伊藤 利洋
- 奈良県立医科大学 免疫学講座 教授
- 松島 綱治
- 東京理科大学 生命医科学研究所 炎症・免疫難病制御部門 教授
- 上羽 悟史
- 東京理科大学 生命医科学研究所 炎症・免疫難病制御部門 准教授<責任著者>
