ニュース&イベント NEWS & EVENTS
SARS-CoV-2変異株の免疫回避を克服する抗体の開発に成功
ワクチン・抗体医薬耐性克服への新たな戦略
国立大学法人東北大学
東京理科大学
発表のポイント
- 新型コロナウイルス感染症COVID-19では、免疫回避型変異株(注1)が次々と発生し、ワクチン耐性、抗体医薬耐性など治療上の困難が生じています。
- 独自のCvMab-62抗体と免疫回避型変異株に無効となった既存の抗体医薬品を組み合わせることで、免疫回避型変異株SARS-CoV-2(注2)に対して感染阻害活性を示す二重特異性抗体(注3)の開発に成功しました。
- 独自の抗体と無効となった既存の抗体医薬を再活用することで、ワクチンや抗体医薬の耐性問題を克服できる新規二重特異性抗体の効率的な開発が可能になりました。
概要
新型コロナウイルス感染症COVID-19では、世界中で次々と出現する変異株による流行が続いています。これらの変異株ウイルスは免疫回避能力を獲得しており、ワクチンや既存抗体医薬に対する耐性の問題は治療上の重要な課題となっており、その克服が望まれています。
東北大学大学院医学系研究科分子薬理学分野の加藤 幸成教授、東京理科大学薬学部感染分子標的学分野の野口 耕司教授、国立感染症研究所細胞化学部の深澤 征義部長らの研究グループは、新型コロナウイルスSARS-CoV-2の表面抗原スパイクタンパク質に対する複数の抗体を組み合わせた様々な二重特異性中和抗体を創出することで、ブレークスルー感染(注4)を起こす免疫回避型変異株のBQ.1株を克服する新規二重特異性中和抗体の開発に成功しました。本研究では、SARS-CoV-2のスパイクタンパク質のS2ドメイン(注5)における新規エピトープ(注6)を認識する独自のCvMab-62抗体を基本骨格とした二重特異性抗体Bis3並びにBis-Bebを創出しました(図1)。これらの成果から、独自のCvMab-62抗体と有益性を失った既存の抗体医薬品を組み合わせることで、免疫回避型SARS-CoV-2変異株の耐性問題を克服できる抗体医薬の効率的な開発につながることが期待されます。
本研究結果は、2024年2月28日、科学誌iScience電子版に掲載されました。
研究の背景
新型コロナウイルス感染症COVID-19に対しては、ワクチンや抗体医薬、プロテアーゼ阻害薬などの治療薬が膨大なコストをかけて開発されました。しかし、世界中で次々に出現する変異株による流行は続いており、グローバルな感染制御に困難が生じています。これらの変異株ウイルスは、コロナワクチンで獲得した免疫能をすり抜ける免疫回避能力を獲得した変異株であり、次々とブレークスルー感染を起こすことや既存の抗体医薬にも耐性を示すことから、その制圧は公衆衛生上の重要な課題となっています。
SARS-CoV-2のスパイクタンパク質の受容体結合部位(Receptor binding domain: RBD)部分は感染初期プロセスに必須なドメインであり、ワクチンや抗体医薬の重要な治療標的となってきました。現在、このRBD領域内のアミノ酸変異により免疫回避能を獲得した変異株が相次いで出現しており、ワクチン耐性、抗体医薬耐性を克服する治療薬の開発が望まれています。例えば、近年流行したSARS-CoV-2変異株であるBQ.1変異株やXBB変異株は、RBD上に複数のアミノ酸変異を持ち、ワクチン接種者におけるブレークスルー感染を起こし、また既存抗体医薬であるベブテロビマブに顕著な耐性形質を示していますが、これらの耐性変異株の流行により、ほぼ全ての抗SARS-CoV-2抗体医薬が無効となっています。
一方、このスパイクタンパク質中で変異が入りにくい部位、特にS2部位と呼ばれる部分を認識し、2つの異なるエピトープを持つ二重特異性抗体は、新規の広域中和抗体医薬モデルとして開発できる可能性があり、耐性変異株出現への対抗手段、ワクチン補完戦略として有用と考えられます。
今回の取り組み
東北大学大学院医学系研究科分子薬理学分野の加藤 幸成(かとう ゆきなり)教授、東京理科大学薬学部感染分子標的学分野の野口 耕司(のぐち こうじ)教授、国立感染症研究所細胞化学部の深澤 征義(ふかさわ まさよし)部長らの研究グループは、免疫回避型変異株のワクチン耐性、モノクローナル抗体医薬耐性克服を目的とし、二重特異性抗体作製技術と既存の抗体医薬品を再活用することで免疫回避型変異株BQ.1株に有効性を示す広域二重特異性中和抗体を新規開発し、その作用機序解明の研究を行いました。
まず、RBD部分を認識するCvMab-6とS2部分を認識するCvMab-62の2種類のマウスモノクローナル抗体を作出し、その抗原受容体可変領域を遺伝子工学的に組換えた二重特異性抗体を作製しました。原型となる2種のモノクローナル抗体は、単独ではウイルス感染阻害活性が弱いものの、抗S2抗体CvMab-62を基本骨格と抗RBD抗体CvMab-6の抗原認識部位(single chain variable fragment: scFv)を組み合わせた IgG-scFv型の二重特異性抗体Bis3は、SARS-CoV-2変異株シュードタイプウイルスに広域中和活性を示すことが明らかになりました。また、親抗体には認められなかったスパイクタンパク質依存的膜融合を顕著に阻害する作用を見出しました(図3)。
これらの知見より、効果が低く役に立たないと思われがちなモノクローナル抗体でも複数を組み合わせれば有効性が得られることから、耐性変異株の出現で無効となった既存の抗体医薬品を再活用できる可能性が示されました。そこで、我々の抗S2抗体CvMab-62と既存抗体医薬であるベブテロビマブの組み合せによる二重特異性抗体を作製し、その感染阻害活性を検討した結果、免疫回避型変異株でベブテロビマブ耐性のBQ.1.1変異株に対して感染阻害活性、抗ウイルス効果を回復させることに成功しました(図3)。
今後の展開
抗S2抗体CvMab-62に二重特異性抗体作製技術を応用することで、耐性変異株の出現で無効となった抗体医薬資源を再活用できることが明らかになりました。本研究は、膨大な研究開発コストをかけて開発された抗体医薬資源を無駄にすることなく、新たなメカニズムに基づく新型コロナウイルス治療薬の創出に貢献することが期待されます。既存の抗体医薬品を改変して新たな付加価値を生み出し再活用することは、バイオシミラーの概念をさらに一歩前進させる考え方であり、様々な疾患に対しても応用可能になることから、医薬資源の持続可能な研究開発戦略にも役立つものと期待されます。
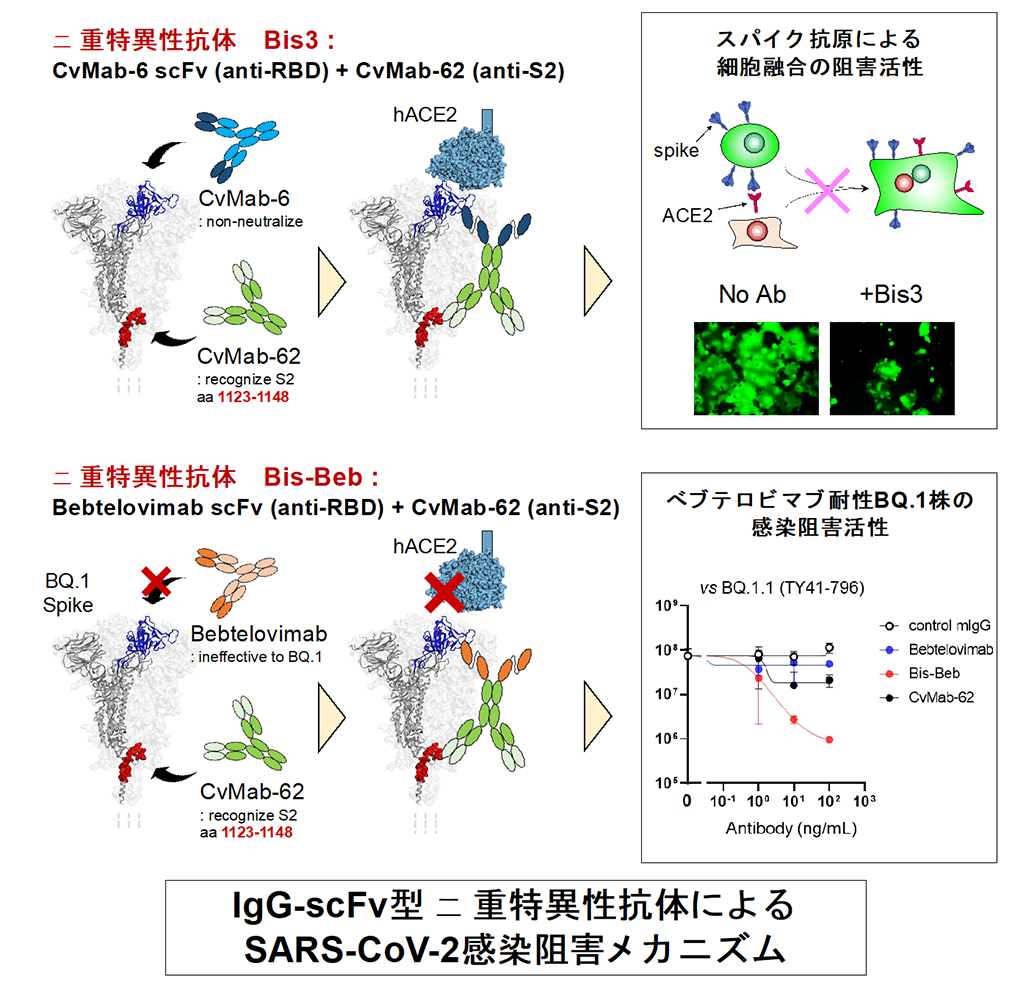
今回開発した二重特異性抗体の1つであるBis3は、ウイルス分子のスパイクタンパク質による膜融合ステップを阻害して感染阻害活性を示す。既存抗体医薬のベブテロビマブとの組み合わせによる二重特異性抗体Bis-Bebは、ウイルス分子のスパイクタンパク質と細胞側受容体ACE2 の結合阻害活性を回復することで、ベブテロビマブ耐性変異株BQ.1に感染阻害活性を示す。
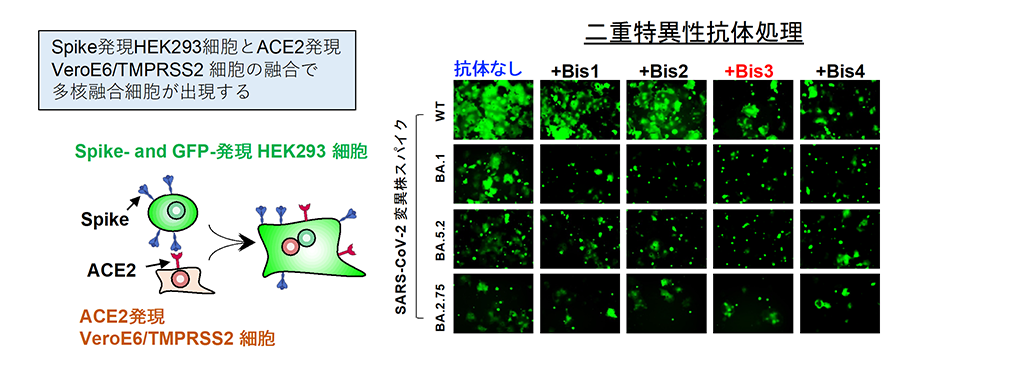
二重特異性抗体の1つであるBis3は、ウイルス分子のスパイクタンパク質発現細胞と細胞側受容体ACE2発現細胞の膜融合ステップを阻害する。膜融合した巨大細胞(緑色)の出現割合がBis3処理で減少している。
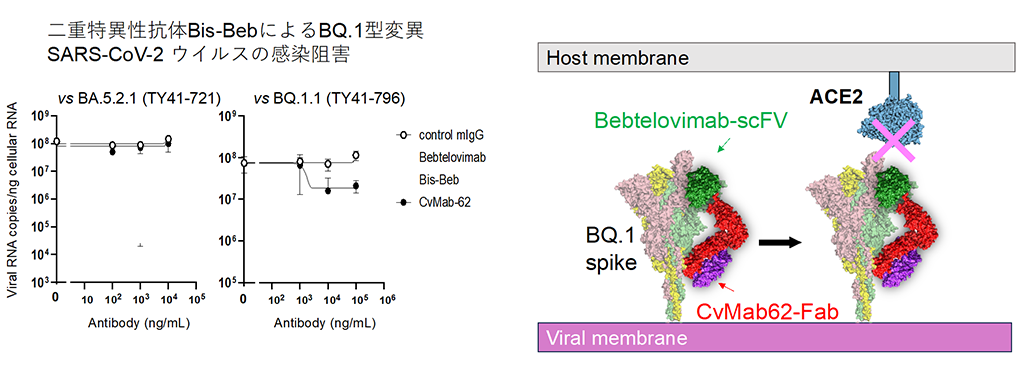
独自抗体のCvMab-62と既存抗体医薬のベブテロビマブとの組み合わせによる二重特異性抗体Bis-Bebは、ウイルス分子のスパイクタンパク質と細胞側受容体ACE2 の結合阻害活性を回復することで、ベブテロビマブ耐性ウイルスBQ .1変異株に感染阻害活性を示す。
謝辞
本研究は、日本医療研究開発機構(AMED)の生命科学・創薬研究支援基盤事業(BINDS)(JP23ama121008)、新興・再興感染症研究基盤創生事業(多分野融合研究領域21wm0325032s0101、21wm0325032j0201)、新興・再興感染症に対する革新的医薬品等開発推進研究事業(21fk0108568h0001、21fk0108568s0101、21fk0108568j0101)、日本学術振興会科学研究費助成事業(JP22K15284)、および三井住友信託銀行株式会社が立ち上げた「新型コロナワクチン・治療薬開発寄付口座」からの助成金を原資として運営された東京理科大学学内助成制度の支援を受けて行われました。
用語説明
- 注1.
- 免疫回避型変異株:抗原性を変化させることにより、感染個体の免疫防御系を回避する能力を獲得した変異株のこと。
- 注2.
- SARS-CoV-2:新型コロナウイルス感染症の原因ウイルスSevere Acute Respiratory Syndrome Coronavirus 2の略称。
- 注3.
- 二重特異性中和抗体:2種類のモノクローナル抗体を遺伝子工学的に組換えた人工抗体で、通常は異なる抗原認識部位を持つ。
- 注4.
- ブレークスルー感染:ワクチン接種して免疫を獲得したと予想される後で、ワクチン対象となる病原体に感染すること。
- 注5.
- スパイクタンパク質のS2ドメイン:SARS-CoV-2の感染に必要な表面抗原スパイクタンパク質は、大きく3つのドメイン(N-terminal domain、RDB、S2 domain)を持ち、S2ドメインは、C末端側にあり細胞融合プロセスに重要な機能を持つ。
- 注6.
- エピトープ:抗体が結合する相手側のタンパク質において、抗体の抗原認識部位が結合する抗原決定部位。
論文情報
タイトル
Overcoming antibody-resistant SARS-CoV-2 variants with bispecific antibodies constructed using non-neutralizing antibodies
著者
Tetsuya Inoue#, Yuichiro Yamamoto, Kaoru Sato, Yuko Okemoto-Nakamura, Yoshimi Shimizu, Motohiko Ogawa, Taishi Onodera, Yoshimasa Takahashi, Takaji Wakita, Mika K. Kaneko, Masayoshi Fukasawa*, Yukinari Kato*, Kohji Noguchi*
#筆頭著者:
東京理科大学大学院薬学研究科 大学院生 井上 徹哉
*責任著者:
東北大学大学院医学系研究科分子薬理学分野 教授 加藤 幸成
国立感染症研究所細胞化学部 部長 深澤 征義
東京理科大学薬学部薬学科感染分子標的学分野 教授 野口 耕司
掲載誌
iScience
