ニュース&イベント NEWS & EVENTS
β-1,2-グルカンの環化に関わるメカニズムを解明
~生理学的に重要な環状β-1,2-グルカン研究の進展に寄与~
東京理科大学
新潟大学
研究の要旨とポイント
- 環状β-1,2-グルカンは宿主との共生や感染、細胞浸透圧の調節などの機能を果たす重要な環状糖鎖です。一方で、環化反応のメカニズムについては未解明な点が多く残されていました。
- 環状β-1,2-グルカン合成酵素の環化反応に関わる領域を単独で発現させ、直鎖状β-1,2-グルカンから環状β-1,2-グルカンを合成する触媒反応のメカニズムを解明しました。
- 本酵素は糖質加水分解酵素(GH)の反応機構を利用して環化(糖転移反応)を行う酵素です。既知のGHとはアミノ酸配列の相同性を示さず、また触媒機構も系統的に大きく異なることから、新たなGH family 189が創設されました。
- 本研究成果は、糖質関連酵素の多様性の一端を明らかにしたものであり、環状β-1,2-グルカンの酵素合成法の確立にもつながる基礎的知見です。
研究の概要
東京理科大学 創域理工学部生命生物科学科の田中 信清助教、齋藤 龍太郎氏(2021年度 学士課程卒業)、中島 将博准教授、政池 知子准教授、産業技術総合研究所 人工知能研究センターの小林 海渡氏、新潟大学 農学部農学科の中井 博之准教授らの共同研究グループは、好熱性細菌Thermoanaerobacter italicus由来の環状β-1,2-グルカン合成酵素(CGS)から環化ドメイン(TiCGSCy)を組み換え型酵素として単独で発現させ、直鎖状β-1,2-グルカンから環状β-1,2-グルカンを合成する触媒機構を明らかにしました。また、本研究成果によりCGSグループにおいて新規な糖質加水分解酵素ファミリー(Glycoside hydrolase family, GHファミリー)189が創設されました。
環状β-1,2-グルカンはさまざまな根粒菌や植物病原菌が生産する多糖であり、宿主との共生因子や免疫調節などの機能が知られています。一般的に、CGSはUDP-グルコースとグルコースから糖鎖の伸長、鎖長の調節、環化といった触媒反応を経て最終的に環状β-1,2-グルカンを合成しますが、最終段階にあたる環化のメカニズムは未解明のままでした。そこで、本研究グループはβ-1,2-グルカンの環化反応メカニズムを明らかにするために研究を行いました。
T. italicus由来のCGSから環化反応を担う推定領域(TiCGSCy)を単独で発現させ、精製により得られた酵素を直鎖状β-1,2-グルカンに作用させることで、TiCGSCyの機能を解析しました。その結果、直鎖状糖鎖のみ分解できるグルコシダーゼでは加水分解されない化合物が生成され、1H-NMRや質量分析の結果から環状β-1,2-グルカンであることが明らかになりました。次に、β-1,2-グルコオリゴ糖(重合度2-10)を基質とした際の反応産物をTLC分析で調べたところ、重合度6以上の基質に対してのみ反応が観察されました。興味深いことに、この反応では通常加水分解によって遊離するはずの重合度3以下の糖は遊離せず、いずれにおいても重合度4以上のβ-1,2-グルコオリゴ糖が遊離しました。この結果は、TiCGSCyが加水分解を行わないユニークな反応機構を有し、重合度6以上のβ-1,2-グルコオリゴ糖に対して糖転移活性を示すことを示唆しています。
X線結晶構造解析によりTiCGSCyの立体構造を解明し、アミノ酸配列の相同性はないものの構造がよく類似していたGH144とGH162に属する酵素と構造を比較することで、TiCGSCyの2つの触媒残基を推定しました。また、これらの部位特異的変異体では、環化活性が顕著に低下、消失したことから、これらが触媒残基であることが明らかとなりました。これにより、TiCGSCyの属するCGSグループは新規な系統グループに属する酵素群であることが示唆され、新たなGHファミリーであるGH189を創設しました。
本研究成果をさらに発展させることにより、生理学的に重要な環状β-1,2-グルカンの合成法の確立や阻害剤の開発につながることが期待されます。
本研究成果は、2024年2月1日に国際学術誌「Applied Microbiology and Biotechnology」にオンライン掲載されました。
研究の背景
β-1,2-グルカンは、グルコースがβ-1,2-グルコシド結合によって数多く連なった多糖類です。特に環状β-1,2-グルカンは、自然界では根粒菌のAgrobacterium tumefaciensやブルセラ症の原因菌であるBrucella abortus、根圏細菌Ensifer melilotiなどが生産し、細菌感染や共生因子に重要な役割を果たすことが報告されています。また、B. abortus由来のCGSは、約20の重合度を持つ環状β-1,2-グルカンを生成し、以下の3つの反応を経てUDP-グルコースとグルコースから環状β-1,2-グルカンを合成することが知られています。
- CGSへのグルコースの共有結合(糖鎖伸長の開始)
- 直鎖状β-1,2-グルカンの鎖長調節(糖鎖長の伸長と調節)
- 直鎖状β-1,2-グルカンの環化(糖鎖の環化)
先行研究にて、上記の各機能を担う推定ドメイン領域については同定報告がありましたが、特に上記の(3)における環化反応の詳細な反応機構は明らかになっていませんでした。そこで本研究では、好熱性細菌であるT. italicus由来のCGSにおける環化ドメイン(TiCGSCy)に焦点を当て、その生化学的機能と立体構造の解析から触媒メカニズムの解明を試みました。
研究結果の詳細
- TiCGSCyの機能解析
- TiCGSCyの構造解析
- TiCGSCyの反応機構
- 加水分解を生じないTiCGSCyのユニークな反応機構
- 新規なGHファミリー189の創設
T. italicusのCGSから推定環化ドメイン(TiCGSCy, 1005-1591番目のアミノ酸配列領域)を組み換え型酵素として発現させ、Ni-NTAアフィニティクロマトグラフィー及び疎水性クロマトグラフィーにより酵素を精製しました。TiCGSCyの機能を評価するために、まず直鎖状β-1,2-グルカンにTiCGSCyを反応させ、生成物を分析しました。得られた生成物を直鎖状糖鎖のみ分解できるβ-グルコシダーゼで処理すると加水分解されない多糖画分とグルコースが遊離し、さらに環状糖鎖も分解できるβ-1,2-グルカナーゼで処理すると多糖画分はβ-1,2-グルコオリゴ糖まで分解されました。この結果は、TiCGSCyが直鎖状β-1,2-グルカンに対し環化活性を有していることを示唆しています。
さらに、上記の多糖画分のみをサイズ排除クロマトグラフィーにより精製し、生成物の詳細な分析を行いました。まず1H-NMRにより分析したところ、直鎖状糖にのみ存在する還元末端由来のシグナルは検出されなかったことから、TiCGSCyが環状β-1,2-グルカンを生成していることが示唆されました。次に、質量分析を行ったところ、重合度が17-26の環状β-1,2-グルカンを生成していることも明らかになりました。さらに、基質の還元末端に存在するアノマー位のヒドロキシ基の向きが反応前後でβ-アノマーのまま保持されていることから、TiCGSCyはアノマー保持型酵素(*1)の機構を有していることも分かりました。次に、β-1,2-グルコオリゴ糖(重合度2-10)を基質とした際の反応産物をTLC分析で調べたところ、重合度6以上の基質に対してのみ反応が観察されました。興味深いことに、この反応では通常加水分解によって遊離するはずの重合度3以下の糖は遊離せず、いずれにおいても重合度4以上のβ-1,2-グルコオリゴ糖が遊離しました。この結果は、TiCGSCyが加水分解を行わないユニークな反応機構を有し、重合度6以上のβ-1,2-グルコオリゴ糖に対して糖転移活性を示すことを示唆しています。
X線結晶構造解析によりTiCGSCyの立体構造を決定したところ、(α/α)6 toroid foldの全体構造を有し、基質結合部位と考えられる大きなポケットも持つことが示唆されました。TiCGSCyはChitinophaga pinensis由来のβ-1,2-グルカナーゼ(CpSGL, GH144に属する)や糸状菌Talaromyces funiculosus由来のβ-1,2-グルカナーゼ(TfSGL, GH162に属する)とアミノ酸配列の相同性は非常に低いものの、構造的にはよく類似していることが分かりました。
一般的なアノマー保持型の反応機構を持つ糖質加水分解酵素は、一般酸/塩基触媒および求核触媒の2つの酸性アミノ酸残基を有していることが知られています。CpSGL(GH144)の複合体構造、TfSGL(GH162)のミカエリス複合体構造及びTiCGSCyの全体構造を重ね合わせ、基質との位置関係からTiCGSCyの触媒残基を探索しました。その結果、サブサイト+2(*2)に挿入されたグルコース分子の3-OH基を介して切断部位のグリコシド結合の酸素原子に作用できる位置にE1356が存在し、サブサイト–1のアノマー中心には直接求核攻撃可能な位置にE1442が存在したことから、それぞれ一般酸/塩基触媒及び求核触媒として推定されました。そこで、各推定残基の部位特異的変異体を作成し、直鎖状β-1,2-グルカンに対する環化活性をTLCにより分析したところ、顕著に活性が低下するか、消失しました。これらの結果はE1356及びE1442が触媒残基であることを強く支持しています。
TiCGSCyの詳細な反応機構をまとめると、下記のようになります。
(a)E1356が一般酸触媒として作用し、サブサイト+2に挿入されたグルコース分子の3-OH基を介して酸素原子にプロトンを供給する。同時に、E1442が求核試薬として作用し、サブサイト–1のアノマー中心を攻撃して、グリコシル酵素中間体を形成する。
(b)E1356が一般塩基として作用し、サブサイト+2に挿入されたグルコース分子の3-OH基を介して、サブサイト+1に挿入されたグルコース分子の2-OH基のプロトンを引き込む。
(c)サブサイト+1の活性化した2-OH基がサブサイト–1の共有結合したグルコース部分のアノマー炭素を攻撃して、糖転移生成物を遊離する。
上記反応では、(a)においてグリコシル酵素中間体を形成した基質分子とは異なる分子のOH基がアノマー炭素原子を攻撃する場合に直鎖状の生成物が得られ、同一分子のOH基であった場合(図1)は環状の生成物が得られることが示唆されました。
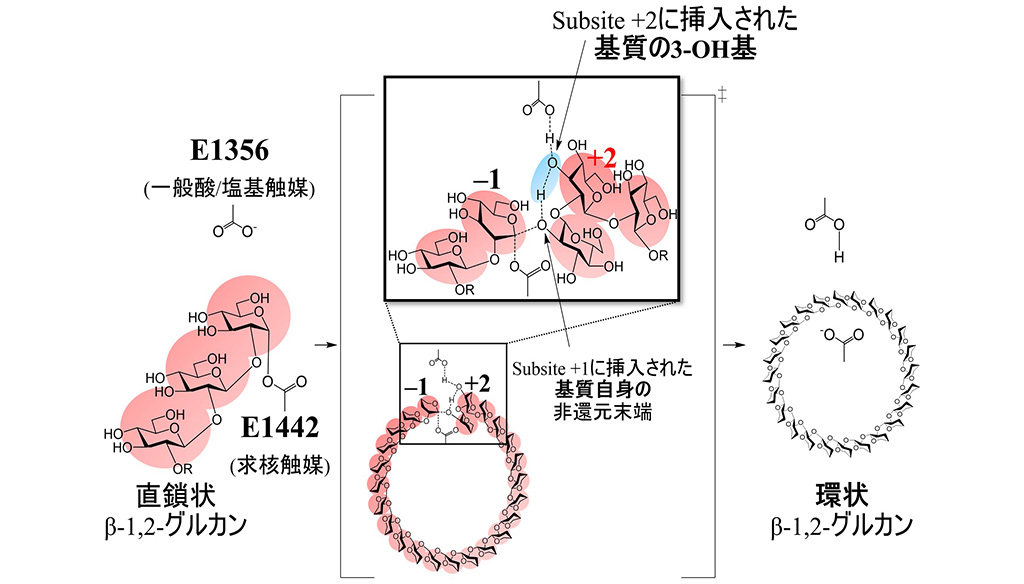
図1 決定されたTiCGSCyの触媒機構
挿入された基質のグルコース分子は赤色で、Subsite +2に挿入された基質の3-OH基は青色で示した。
またβGはβ-1,2-グルカンを示す。
一般的な糖転移反応を行う酵素では、反応の前半で求核触媒残基がサブサイト–1に位置するグルコース分子のアノマー中心を攻撃し、グリコシル酵素中間体を形成します。反応の後半では、このアノマー中心がどの分子のOH基によって攻撃されるかによって反応経路が変わり、例えば、水分子による攻撃は加水分解反応を引き起こします。
先に述べたように、TiCGSCyは加水分解反応を起こさない独特な反応機構を持っていることが示唆されました。この点は、TiCGSCyのE1356がサブサイト+2に位置するグルコース分子の3-OH基を介して、アノマー中心を直接攻撃するサブサイト+1に位置するグルコース分子の2-OH基を活性化する必要があることを考慮すると、より容易に説明できます。なぜならば、加水分解反応が生じるためには、前述の計2か所のOH基(サブサイト+2に位置するグルコース分子の3-OH基とサブサイト+1に位置するグルコース分子の2-OH基)が、各1個の水分子のOH基に置き換わる必要があるからです。しかしながら、このような環境で溶液中をブラウン運動している水分子2個が同時にちょうど反応に適した位置に配置される確率は非常にまれであり、立体構造から推定した反応経路からも加水分解反応は生じないということが明らかです。
TiCGSCyの一般酸/塩基触媒であるE1356の位置と、TfSGL(GH162)の一般酸触媒残基やCpSGL(GH144)の推定触媒残基の位置は、非常によく保存されていました。このことから、サブサイト+2に挿入されたグルコース分子の3-OH基を介して行う触媒機構は、これら3者で共通していることが示唆されました。一方で、TfSGL及びCpSGLはアノマー反転型酵素(*3)の反応機構を有しており、アノマー保持型の反応機構を持つTiCGSCyとは触媒機構がそもそも根本的に異なるグループであることも示唆されています。そのため、TiCGSCyの属するCGSグループは新たなGHファミリーであるGH189を創設しました。
本研究を主導した東京理科大学の田中助教は「近年、飛躍的に研究が進んでいるβ-1,2-グルカン関連酵素において、β-1,2-グルカンの環化に関わるメカニズムを明らかにすべく、本研究に着手いたしました。本研究成果は、環状β-1,2-グルカンの酵素合成法確立への一助になることが期待されます」と、研究成果についてコメントしています。
※本研究におけるX線データに関する実験は、高エネルギー加速器研究機構 物質構造科学研究所の放射光実験施設Photon Factory(2020G527, 2024G685)を利用して行われました。
用語
*1 アノマー保持型酵素
基質の還元末端に存在するアノマー位のヒドロキシ基の向きが反応前後で保持される酵素のことです。一般的には2つの酸性アミノ酸残基が、それぞれ一般酸/塩基触媒及び求核触媒として作用します。この触媒機構では、前半のグリコシル化ステップと後半の脱グリコシル化ステップに分かれて進行します。グリコシル化ステップでは、切断部位の近傍に存在する一般酸/塩基触媒が一般酸として作用し、グリコシド結合中の酸素原子に直接プロトンを供給します。同時に、求核触媒がアノマー位の炭素原子に求核攻撃して、グリコシル酵素中間体を形成します。脱グリコシル化ステップでは、一般酸/塩基触媒が一般塩基として作用し、求核攻撃を行う基質のOH基を活性化、アノマー位の炭素原子に求核攻撃することで脱グリコシル化反応が終了します。
*2 サブサイト
糖の加水分解部位を基点として、基質のグルコース分子が結合する酵素の結合部位を示します。還元末端側を+、非還元末端側を–としてサブサイト番号が定義されています。
*3 アノマー反転型酵素
基質の還元末端に存在するアノマー位のヒドロキシ基の向きが反応産物で反転する酵素のことです。一般的には2つの酸性アミノ酸残基が、それぞれ一般酸触媒及び一般塩基触媒として作用します。
論文情報
雑誌名
Applied Microbiology and Biotechnology
論文タイトル
Functional and structural analysis of a cyclization domain in a cyclic β-1,2-glucan synthase
著者
Nobukiyo Tanaka, Ryotaro Saito, Kaito Kobayashi, Hiroyuki Nakai, Shogo Kamo, Kouji Kuramochi, Hayao Taguchi, Masahiro Nakajima and Tomoko Masaike
DOI
発表者
- 田中 信清
- 東京理科大学 創域理工学部 生命生物科学科 嘱託助教 <筆頭著者、責任著者>
- 齋藤 龍太郎
- 東京理科大学 創域理工学部 生命生物科学科 2021年度 学士課程卒業
- 小林 海渡
- 産業技術総合研究所 人工知能研究センター 産総研特別研究員
- 中井 博之
- 新潟大学 農学部 農学科 准教授
- 加茂 翔伍
- 東京理科大学理工学部応用生物科学科 日本学術振興会特別研究員PD(研究当時)
- 倉持 幸司
- 東京理科大学 創域理工学部 生命生物科学科 教授
- 田口 速男
- 東京理科大学 創域理工学部 生命生物科学科 名誉教授
- 中島 将博
- 東京理科大学 創域理工学部 生命生物科学科 准教授 <責任著者>
- 政池 知子
- 東京理科大学 創域理工学部 生命生物科学科 准教授 <責任著者>
