ニュース&イベント NEWS & EVENTS
銅錯体とリゾチームを組み合わせた新規複合タンパク質の合成に成功
~金属錯体の機能を保持したタンパク質の実現に寄与、医療応用に期待~
研究の要旨とポイント
- 銅(Cu)錯体とリゾチームを組み合わせた複合タンパク質(CuST@lysozyme)を合成し、その結晶構造と分光学的、電気化学的特性を明らかにしました。
- 今回合成した複合タンパク質が、既報の銅化合物よりもすぐれた活性酸素除去能力(SOD活性作用)を有することを実証しました。
- 本研究成果を応用することで、生体内に使用可能な新たな治療薬開発への貢献が期待されます。
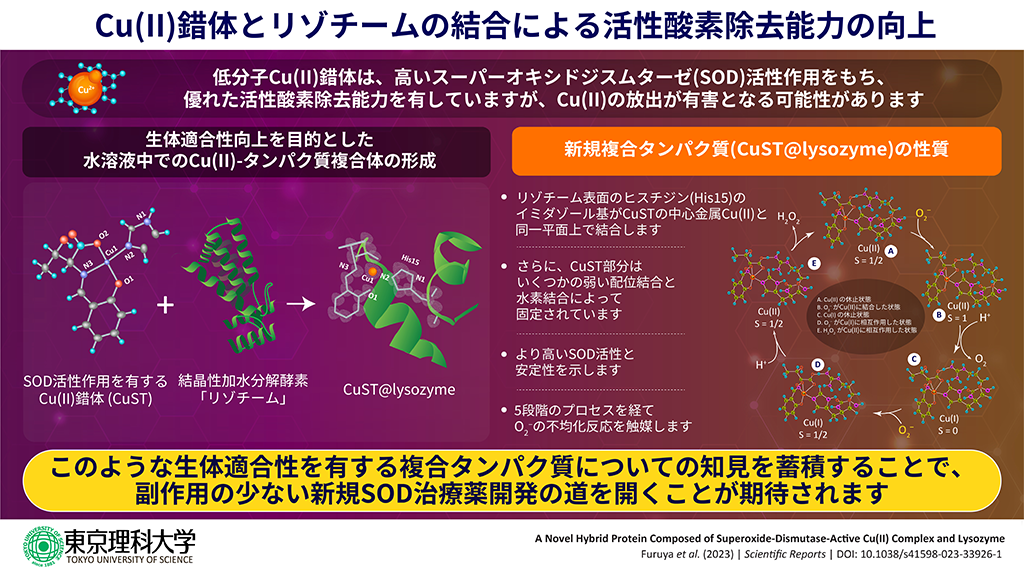
東京理科大学理学部第二部化学科の中根大輔助教、秋津貴城教授、同大学理学部第一部化学科の北西健一助教、ロシアの南部連邦大学のArshak Tsaturya博士、茨城大学大学院理工学研究科量子線科学専攻の海野昌喜教授らの共同研究グループは、スーパーオキシドジスムターゼ(SOD, ※1)活性作用を有するCu(II)錯体(CuST)とリゾチーム(※2)を組み合わせた新規複合タンパク質(CuST@lysozyme)を作製し、その結晶構造と物性を解明することに成功しました。また、CuSTのSOD活性作用は、SOD活性作用をもたないリゾチームと複合体を形成しても保持されていることを明らかにしました。本研究により、錯体のさまざまな機能をタンパク質に付与できる可能性を示されました。今後、本成果を礎としてさらに発展させることで、新たな機能性物質創製の促進への貢献が期待されます。
地球上の生物の多くは、酸素を利用して生命活動を維持しています。酸素の一部は反応性の高い活性酸素に変化し、免疫機能や感染防御としての役割を担っています。一方で、生体内で活性酸素が過剰に生産されると細胞を損傷させ、がんをはじめとしたさまざまな疾患をもたらす原因にもなります。その防御機構の1つであるSODは超酸化物イオン(O2−)を酸素(O2)と過酸化水素(H2O2)に不均化する金属酵素です。これらの多くは、生体内に有用なはたらきをする一方、安定性の面で課題がありました。そこで、本研究グループは、O2−を除去する機能を有するCu(II)錯体に注目し、O2−を除去する機能をもたないリゾチームを複合化したタンパク質の合成に挑戦し、金属錯体の機能をタンパク質に付与させると同時に、安定性も併せもつ物質の実現を目指して、研究を進めてきました。
今回、スレオニン誘導体を有するCu(II)錯体(CuST)とリゾチームを組み合わせた新規複合タンパク質(CuST@lysozyme)の合成と単結晶化に成功しました。CuST@lysozymeの結晶構造から、CuSTがリゾチームに結合していることが確認されました。また、紫外可視吸収スペクトル(UV-Vis)やサイクリックボルタンメトリー(CV)などの結果からも、CuSTとリゾチームが結合していることが裏付けられました。さらに、CuSTとリゾチームを複合化しても、CuSTの有するSOD活性作用が低下しないことから、金属錯体の機能をタンパク質に付与できる可能性が示唆されました。
本研究をさらに発展させることで、SODの分解を抑制した、新たな治療薬を設計するための指針となることが期待されます。
本研究の成果は、2023年4月27日に国際学術誌「Scientific Reports」にオンライン掲載されました。
研究の背景
ヒトをはじめとした多くの生物は、呼吸によって酸素を消費し、生命維持に必要なエネルギーを生産しています。このとき副産物として、ヒドロキシラジカル(·OH)、一重項酸素(1O2)、過酸化水素(H2O2)、超酸化物イオン(O2−)などの活性酸素が発生します。これらの活性酸素は生体内の免疫や防御機構としてはたらきますが、過剰に産生されると、脂質、糖質、ホルモン、タンパク質、核酸などの生体内細胞に損傷を与えることが知られています。特に、O2−は水素イオン(H+)と反応することで、·OHやH2O2などの他の活性酸素を生成するため、優先して除去する必要があります。
このO2−由来の損傷を回避するために、多くの生物はSODと呼ばれる金属酵素を保有しています。SODは、O2−をH2O2とO2へ不均化する触媒作用を持っており、生体分子を酸化的損傷から守る重要な役割を担っています。
今回、本研究グループはタンパク質がCu(II)イオンに強く結合する性質を活用し、リゾチームとCu(II)錯体からなる新たな複合タンパク質の合成を行いました。そして、結晶構造や分光学的・電気化学的特性を調べることで、化合物の安定性、生体適合性などを評価しました。
研究結果の詳細
本研究では、複合タンパク質の血漿や細胞質などの生体内での安定性を向上させるため、以下の3点を考慮した分子設計を行いました。
- 配位子の解離を抑制するために、Cu(II)錯体をリゾチームと併用。
- Cu(II)錯体とリゾチームとの相互作用を高めるために、水素結合部位を持つ配位子を使用。
- リゾチームが塩基性側鎖を多く含むため、配位子に酸性官能基を導入。
また、リゾチーム表面のヒスチジン(His15)のイミダゾール基が中心金属Cu(II)イオンと結合可能なこと、アルギニン(Arg14)のグアニジニウム基、スレオニン(Thr89)のOH基が配位結合や水素結合を介して中心金属Cu(II)イオンと相互作用できることなど、アミノ酸部位との作用を考慮し、スレオニン誘導体を有するCu(II)錯体(CuST)を作製しました。さらに、中心金属周りの挙動を詳しく調べるため、イミダゾールが結合したCu(II)錯体(CuST-Imi)と今回の目的であるリゾチームが結合した複合タンパク質(CuST@lysozyme)を作製しました。
今回CuST@lysozymeの単結晶が得られたため、結晶構造の詳細を調べることができました。CuSTの中心金属付近にあるヒスチジンのイミダゾール基は、中心のCu(II)イオンと配位して平面正方形構造を形成していることがわかりました。また、スレオニン側鎖がCu(II)中心に向き、弱い結合を形成していることが確認されました。さらに、アルギニン側鎖の1つは、CuSTのOH基と水素結合を形成していることもわかりました。これらの構造的特徴から、CuST@lysozymeのCuSTは、Cu(II)中心へのイミダゾール基の配位に加えて、水素結合をはじめとしたいくつかの相互作用によって固定されていることが示唆されました。
CuST-ImiとCuST@lysozymeの電気化学的挙動を理解するために、サイクリックボルタンメトリー(CV)測定を行いました。その結果、CuST-Imi、CuST@lysozymeのどちらもCu(I)/Cu(II)の酸化還元に対応するピークが得られました。一方、掃引速度を上げると、CuST@lysozymeでは、酸化還元ピークは明確ではありませんでした。これは、CuST@lysozymeの分子サイズが大きいため、溶液中での拡散が遅くなること、電極へのアクセスが悪くなることで、電子移動が遅くなることに起因すると考えられます。以上は、CuSTがリゾチームと結合して複合タンパク質を形成していることを裏付ける結果であるといえます。
CuST-ImiとCuST@lysozymeのSOD 活性作用を調べるため、IC50値(※3)を測定しました。その結果、CuST-Imi、CuSTのIC50値は、それぞれ131μMと143μMで、リゾチーム(>>2000μM)やCuCl2(292μM)より優れた値を示すことがわかりました。また、CuSTはリゾチームに結合しても、CuSTのSOD活性作用が保持されていることが示唆されました。一方、CuSTのSOD活性作用は、リゾチームと結合しても向上しないことがわかりました。CuSTのOH基がArg14のグアニジニウム基と水素結合を形成することで正電荷が中和されるため、O2−イオンはArg14のグアニジニウム基と強い静電相互作用を形成することができないことがその原因であると考えられます。
今回の研究成果について、研究を主導した中根助教は「今回、タンパク質に金属錯体特有の性質を付与させることを目的として、その複合化に取り組んできました。金属錯体には有用な機能をもつものが多く存在しますが、そのほとんどは直接生体に投与すると有害だと言われています。本研究成果により、生体への負荷を軽減しつつ、生体内での金属錯体の機能を発現させることが可能になることが期待されます」とコメントしています。
※本研究は、日本学術振興会(JSCS)の科研費(20H00336)、ロシアの科学・高等教育省(No. 0852-2020-0019)、南部連邦大学(No. BAZ0110/20-1-03EH)による支援を受けて実施されました。
用語
※1 スーパーオキシドジスムターゼ(SOD): 細胞内に発生した活性酸素を除去する金属酵素。Ni、Fe、Mn、Cu、Znなどの金属イオンを含むSOD錯体が報告されている。
※2 リゾチーム: 細菌の細胞壁を加水分解し、強度を低下させることで、溶菌作用を示す酵素。
※3 IC50: 50%阻害濃度、半数阻害濃度のこと。物質が特定の生物学的プロセスを50%阻害することができる濃度を示す。
論文情報
雑誌名
Scientific Reports
論文タイトル
A novel hybrid protein composed of superoxide-dismutase-active Cu(II) complex and lysozyme
著者
Tetsundo Furuya, Daisuke Nakane, Kenichi Kitanishi, Natsuki Katsuumi, Arshak Tsaturyan, Igor N. Shcherbakov, Masaki Unno and Takashiro Akitsu
