ニュース&イベント NEWS & EVENTS
新型コロナウイルス スパイクタンパク質の弱点部位を同定
488番目のシステイン残基が新規治療標的部位となる可能性
東北大学大学院医学系研究科
東京理科大学
発表のポイント
- 新型コロナウイルスが宿主細胞に感染するにあたり、スパイクタンパク質(Sタンパク質)注1の488番目のシステイン(C488)が必要であることを見出した。
- Sタンパク質のC488を別のアミノ酸に変異させるとSタンパク質の活性化と分泌経路への移行が阻害されることを明らかにした。
- 新型コロナウイルスのSタンパク質C488位は、新たなメカニズムに基づく治療薬の分子標的として期待される。
研究概要
新型コロナウイルスが細胞に感染する仕組みを理解することは、治療薬の標的や治療法を開発する上で重要です。東京理科大学薬学部感染分子標的学分野の野口耕司教授、東北大学大学院医学系研究科分子薬理学分野の加藤幸成教授、国立感染症研究所細胞化学部の深澤征義部長の研究グループは、新型コロナウイルスの感染過程に重要な役割を果たしているSタンパク質の活性化に必要なアミノ酸残基を同定しました。さらにはこのSタンパク質の488番目のシステイン残基を別のアミノ酸残基(アラニン)に変異させると、Sタンパク質の活性化と分泌経路への移行が阻害され、感染機能が失われることを明らかにしました。本研究は、新型コロナウイルスのSタンパク質の機能を失活させるための標的として、488番目のシステイン残基の分子機能を初めて明らかにした重要な報告です。本研究によって、新たなメカニズムに基づく新型コロナウイルス治療薬の開発に貢献することが期待されます。
本研究成果は、2022年12月13日International Journal of Molecular Sciences誌(電子版)に掲載されました。
研究内容
新型コロナウイルスが細胞に感染する仕組みを理解することは、治療薬の標的や治療法を開発する上で重要です。新型コロナウイルスのSタンパク質はウイルス感染の最初の段階において、細胞への接着と細胞膜融合に働く重要な因子であることが報告されています。Sタンパク質が膜融合において働くためには、通常、細胞内のタンパク質分解酵素によって特定の部位で切断され、活性化型に成熟することが必要です。
今回、東京理科大学薬学部 感染分子標的学分野の野口耕司(のぐち こうじ)教授、山本雄一朗(やまもとゆういちろう)助教、東北大学大学院医学系研究科 分子薬理学分野の加藤幸成(かとう ゆきなり)教授、同・抗体創薬共同研究講座 金子美華(かねこ みか)准教授、国立感染症研究所細胞化学部 深澤征義(ふかさわ まさよし)部長の研究グループは、新型コロナウイルスの感染過程に重要な役割を果たしているSタンパク質の活性化に必要なアミノ酸残基(488番目のシステイン残基)を変異させると、Sタンパク質の活性化と分泌経路への移行が阻害され、感染機能が失われるということを明らかにしました(図1)。
これまでに研究グループは、Sタンパク質の488番目のシステイン残基(C488)が、新型コロナウイルスの感染性に重要であることを報告しています。本研究では、C488変異がSタンパク質の活性化と細胞外への分泌に与える影響について解析しました。C488に変異を持つSタンパク質の細胞内局在を解析した結果、Sタンパク質の分泌装置(ゴルジ装置注2)および細胞表面への局在化が低下していました(図2)。また、新型コロナウイルスのSタンパク質のC488変異体を培養細胞で発現させ、タンパク質分解酵素で処理したところ、切断されるSタンパク質の量が著しく減少していることが明らかになりました(図3)。さらに、細胞の分泌経路(小胞体注3からゴルジ体への細胞内移行)を薬剤で阻害すると、Sタンパク質の切断と細胞膜融合の活性が抑制されました。以上の結果から、Sタンパク質のC488残基はSタンパク質の機能に必要な細胞内移行と切断に関与することが明らかになりました。
結論:本研究によって、新型コロナウイルスSタンパク質のC488残基の感染過程における役割が明らかになりました。Sタンパク質のC488残基は、新たなメカニズムに基づく新型コロナウイルス治療薬の分子標的となることが期待されます。
支援:本研究は、日本医療研究開発機構(AMED)生命科学・創薬研究支援基盤事業(BINDS)、文部科学省科学研究費補助金、および三井住友信託銀行株式会社が立ち上げた「新型コロナワクチン・治療薬開発寄付口座」からの助成金を原資として運営された東京理科大学学内助成制度の支援を受けて行われました。
用語説明
注1 スパイクタンパク質(Sタンパク質)
ウイルスが細胞内へ侵入するために必要な、ウイルス表面に存在するタンパク質。
注2 ゴルジ装置
細胞内小器官のひとつで、細胞外に分泌されるタンパク質の切断や糖鎖修飾に機能する。
注3 小胞体
細胞内小器官のひとつで、小胞体で膜タンパク質が合成される。
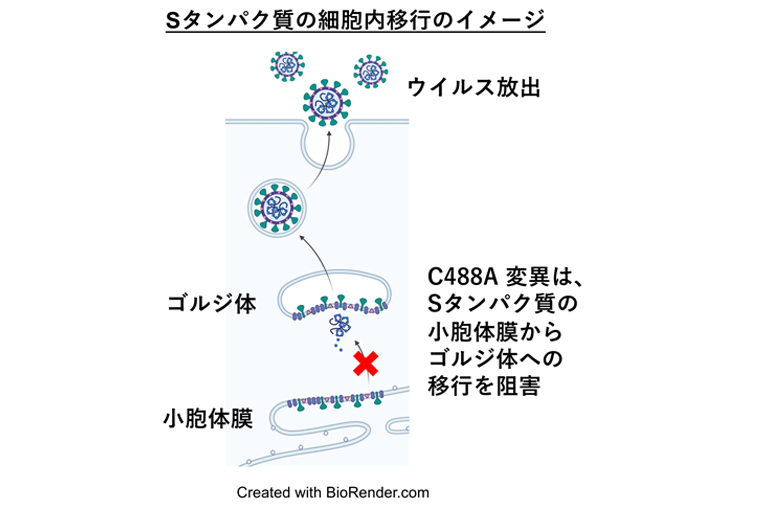
Sタンパク質が細胞内に発現すると小胞体膜からゴルジ装置に輸送され、ゴルジ装置で成熟し、ウイルス粒子に取り込まれて細胞外に放出される(下から上方向)。C488に変異があるとこの移行が阻害される。
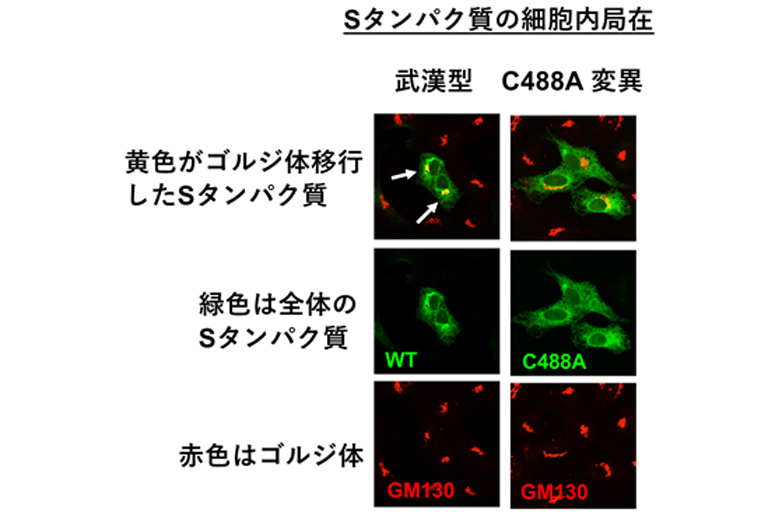
Sタンパク質の細胞内局在を緑色に、ゴルジ装置を赤色で示す。Sタンパク質がゴルジ装置に移行すれば、緑と赤の重なりで黄色に見えるが、C488A変異タンパク質では黄色が少ないことから、Sタンパク質のゴルジ体移行が阻害されていることがわかる。
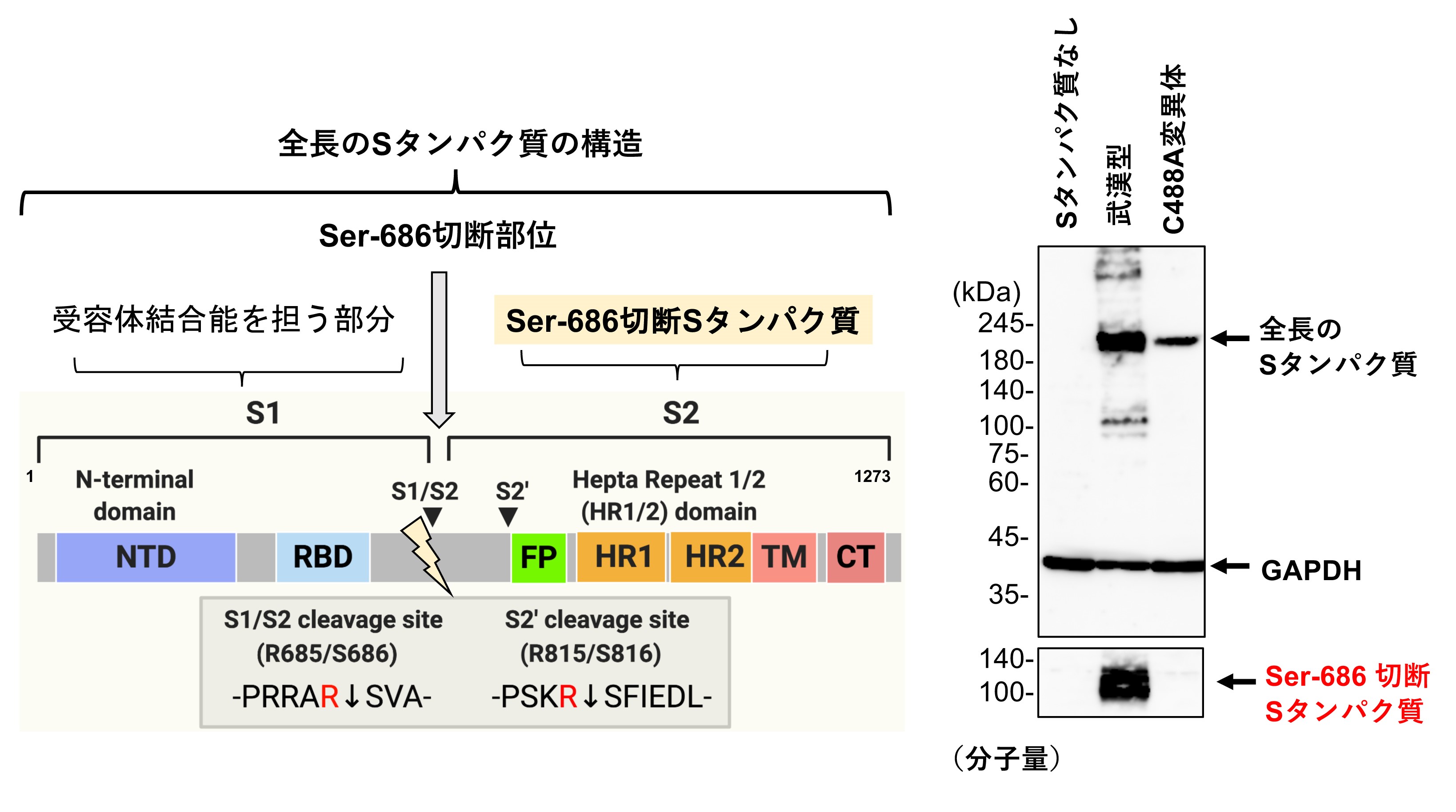
Sタンパク質の686番目のセリン(Ser-686)残基で切断された左半分は細胞への接着に機能する領域、右半分は細胞への侵入に機能する領域。武漢型Sタンパク質では切断されたSタンパク質が検出されているが(右写真の下)、C488A変異体では検出されていない。このことから、C488A変異体はSer-686で切断されないことが分かる。
論文情報
雑誌名
International Journal of Molecular Sciences
論文タイトル
SARS−CoV−2 Spike Protein Mutation at Cysteine−488 Impairs Its Golgi Localization and Intracellular S1/S2 Processing
著者
Authors:Yuichiro Yamamoto, Tetsuya Inoue, Miyu Inoue, Mana Murae, Masayoshi Fukasawa, Mika K. Kaneko, Yukinari Kato, and Kohji Noguchi
DOI
お問い合わせ先
(研究に関すること)
東北大学大学院医学系研究科分子薬理学分野
教授 加藤 幸成 (かとう ゆきなり)
電話番号:022-717-8207
Eメール:yukinari.kato.e6【@】tohoku.ac.jp
東京理科大学薬学部薬学科
教授 野口 耕司 (のぐち こうじ)
Eメール:noguchi-kj【@】rs.tus.ac.jp
(取材に関すること)
東北大学大学院医学系研究科・医学部広報室
電話番号:022-717-7891
FAX番号:022-717-8187
Eメール:pr-office【@】med.tohoku.ac.jp
東京理科大学 広報課
電話番号:03-5228-8107
Eメール:koho@admin.tus.ac.jp
【@】は@にご変更ください。
