ニュース&イベント NEWS & EVENTS
樹状細胞免疫受容体(DCIR)の機能阻害により、大腸炎や大腸腫瘍を抑制できることを発見
~全く新しい作用機序をもつ新規治療薬の開発に期待~
研究の要旨とポイント
- C型レクチン受容体(*1)の一つであるDCIR(*2)を欠損させたマウスでは、デキストラン硫酸ナトリウム(DSS)投与により大腸炎を誘導したとき、症状が軽くなることを発見しました。
- 同様にアゾキシメタン(AOM)とDSS投与により大腸腫瘍を誘導したときも、DCIR欠損マウスでは腫瘍の発生が抑制されました。
- DSS誘導大腸炎、AOM-DSS誘導大腸腫瘍共に、DCIRのリガンドであるアシアロ2本鎖N型糖鎖(NA2)(*3)に対する抗体を投与することにより抑制できることがわかりました。
- 本研究の成果は炎症性腸疾患や大腸癌等のヒト疾患の病態理解と治療法開発に貢献することが期待されます。
東京理科大学生命医科学研究所実験動物学研究部門の岩倉 洋一郎(いわくら よういちろう)教授らの研究グループは、C型レクチン受容体の一つである樹状細胞免疫受容体(DCIR)を欠損させたマウスが、ヒト潰瘍性大腸炎のモデルであるデキストラン硫酸ナトリウム(DSS)誘導大腸炎に対し、耐性を示すことを発見しました。また、このDCIR欠損マウスでは、アゾキシメタン(AOM)とDSSで誘導した大腸腫瘍の発生も抑制されました。
先に研究グループは、アシアロ2本鎖N型糖鎖(NA2)がヒトおよびマウスDCIRの機能的リガンドであることを同定しており、今回、このNA2に対する阻害抗体を作製し、DSSまたはAOM-DSS処理した野生型マウスに投与したところ、大腸炎および大腸腫瘍の発症が強く抑制されることを見出しました。
これらの結果は、DCIRが腸管の炎症および炎症依存的な大腸腫瘍の発症を促進していることを示しており、DCIRを阻害することによって大腸炎や大腸癌を抑制する、新たな治療法の開発につながることが期待されます。
本研究成果は、2022年8月2日に国際学術誌「Cell Reports」にオンライン掲載されました。
研究の背景
研究グループは、以前の研究で、独自に作製したDCIR欠損マウスが自己免疫(*4)を発症すること(Fujikado et al., Nat. Med., 2008)を見出しました。また、DCIRが樹状細胞における抗原提示を制御する上で重要な役割を担っていることを明らかにしました(Kaifu et al., J. Exp. Med., 2021)(※1)。
DCIR欠損マウスは骨代謝異常を示すこと(Maruhashi et al., J. Immunol., 2015)から、DCIRは免疫システムと骨代謝系を制御する生体システムの維持に極めて重要な分子であると考えられます。しかしながら、腸管免疫は他の臓器の免疫制御機構とは大きく異なっており、DCIRが腸管免疫に果たす役割はこれまで解っていませんでした。そこで、本研究ではDCIRの腸管免疫における役割を解析しました。
(過去のプレスリリース)
※1「シアル酸除去による関節リウマチや多発性硬化症等の治療〜骨代謝系と免疫システムを抑制する新たな制御機構の解明〜」
URL: https://www.tus.ac.jp/today/archive/20211027_8394.html
研究結果の詳細
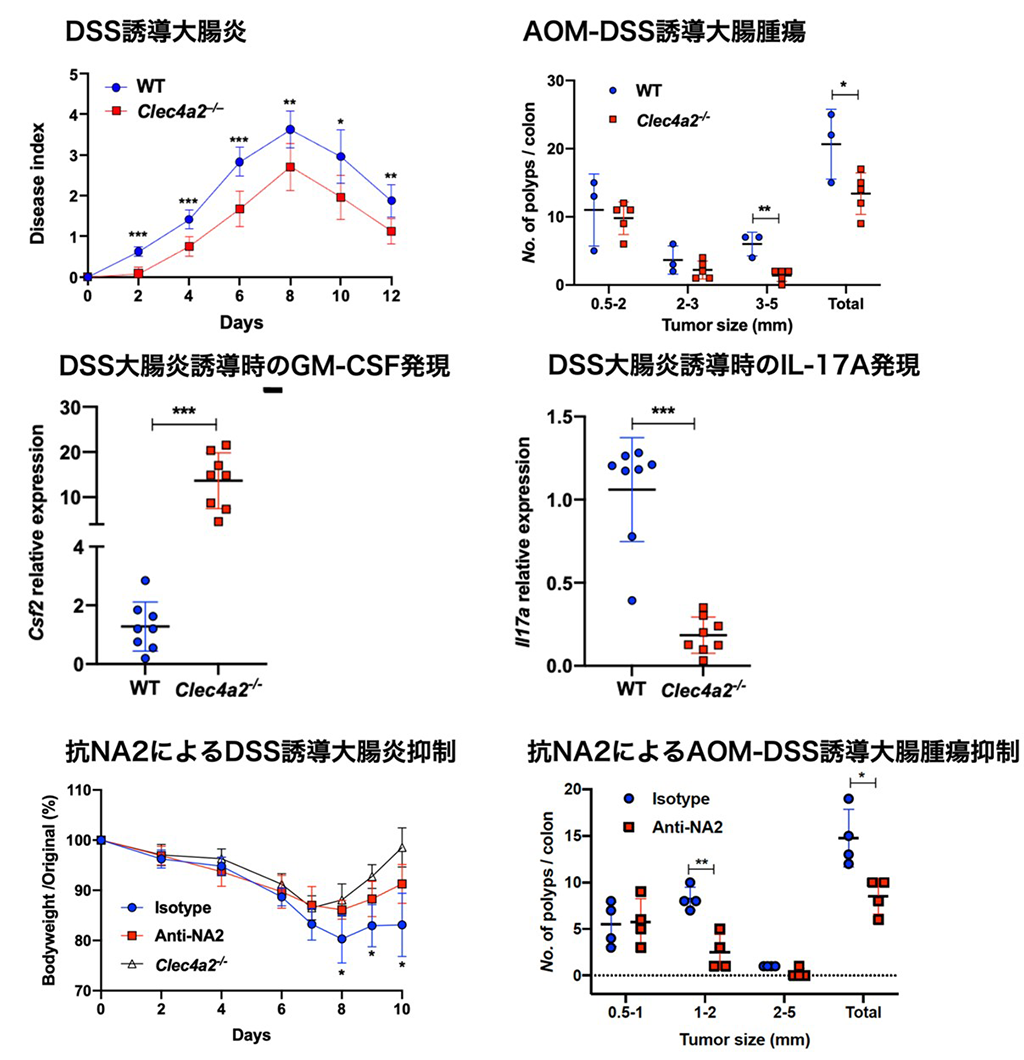
DSSを含む飲用水をマウスに飲ませることにより、ヒトの潰瘍性大腸炎に似た大腸炎をマウスに誘導することができます。このようにして大腸炎を誘導したところ、DCIR欠損マウスでは野生型マウスに比べ炎症の程度が軽いことがわかりました(図1)。
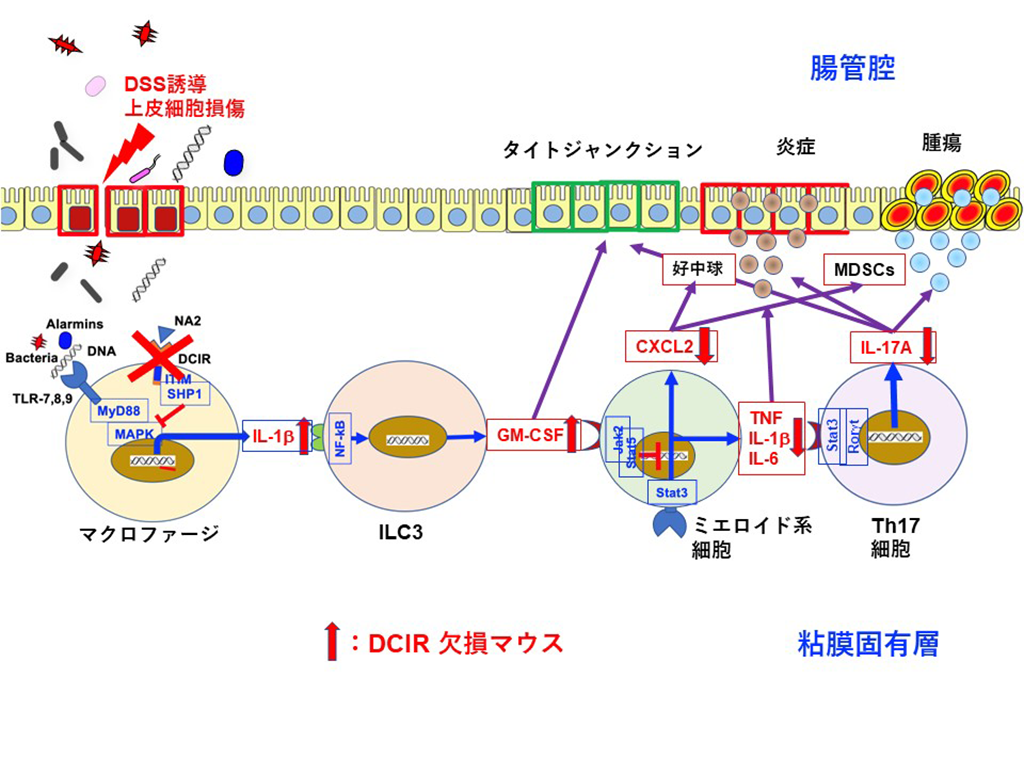
このとき、大腸での遺伝子発現を解析すると、DCIR欠損マウスではIL-17、IL-6、IL-1β、TNFなどの炎症性サイトカイン(*5)の発現が低下すると共に、GM-CSF(*6)の発現が亢進していました。また、ClaudinやOccludinなどのタイトジャンクション(*7)構成タンパク質の発現も亢進していました。
特に強い発現誘導が見られたGM-CSFは、IL-1βの刺激によって3型自然免疫リンパ球(ILC3)から産生され、STAT5(*8)のリン酸化促進を介して、IL-17などの炎症性サイトカインの発現を阻害し、これにより大腸炎を抑制することがわかりました(図2)。
DCIRは、障害を受けた腸管上皮、あるいはそこから浸潤した腸内細菌からの刺激によって生じるトル様受容体(TLR)(*9)の細胞内活性化シグナルを負に制御しています。DCIR欠損マウスでは、この制御がはたらかないため、TLRシグナルにより過剰にIL-1βが産生され、ILC3から過剰にGM-CSFが産生されたものと考えられます。
GM-CSFを野生型マウスに投与すると大腸炎が抑制されることから、過剰のGM-CSFが他の炎症性サイトカインの発現を抑制すると共に、タイトジャンクション構成成分の発現を誘導することによって細胞間接着を促進し、大腸炎を抑制していることが示唆されました。このような現象は、GM-CSF産生細胞であるILC3が腸管に特徴的に豊富に分布しているために起こると考えられます。
このようなGM-CSFの過剰産生は、DCIR欠損マウスをAOMとDSSで処理したときにも見られ、同様に炎症が抑制される結果、大腸腫瘍の発生が抑制されることが示唆されました。
また、DCIRのリガンドであるNA2に対する抗体をDSS、あるいはAOM-DSSで処理した野生型マウスに投与すると、DCIRとNA2の結合が阻害され、大腸炎や大腸腫瘍の形成が阻害されることがわかりました。
展望
今回の研究の結果、DCIRシグナルが腸管で炎症や発癌を助長していることが明らかとなり、DCIRを阻害することによって潰瘍性大腸炎や大腸腫瘍を抑制できる可能性が示唆されました。実際、DCIRのリガンドであるNA2に対する抗体を投与すると、DCIRとNA2の結合が阻害され、大腸炎や大腸腫瘍の形成が阻害されることから、本研究の成果は炎症性腸疾患や大腸腫瘍に対する新たな治療法の開発につながるものと考えています。
※本研究は、日本医療研究開発事業AMED(16809407)および文部科学省科学研究費(18H02671、20H04954、21H02394)の助成を受けて実施したものです。
用語
*1 C型レクチン受容体
自然免疫系細胞に発現するパターン認識受容体の一つで、真菌や細菌の特徴的な構造を認識して感染防御反応を誘導する。活性化シグナルを惹起するものと、抑制性シグナルを惹起するものがある。しかし、DCIRのような一部のC型レクチン受容体は、生体防御以外の機能を果たすことが最近わかりつつある。
*2 DCIR (Dendritic Cell Immunoreceptor、樹状細胞免疫受容体)
抑制性C型レクチン受容体の一つで、樹状細胞、マクロファージ等のミエロイド系細胞に発現する。膜貫通型の受容体タンパク質で、細胞外にアシアロ2本鎖N型糖鎖を認識する糖鎖認識領域を、細胞内にはITIM (Immunoreceptor Tyrosine-based Inhibitory Motif、免疫受容体チロシン抑制性モチーフ)と呼ばれるアミノ酸配列モチーフをもつ。フォスファターゼがITIMに結合することにより、細胞内に抑制性シグナルが伝えられる。
*3 アシアロ2本鎖N型糖鎖 (NA2)
タンパク質や細胞表面に存在するN型糖鎖のうち、糖鎖末端にあるシアル酸が除去された2本鎖糖鎖。
*4 自己免疫
自己の成分に対する免疫寛容が破綻し、自己の成分に対しても免疫細胞が攻撃するようになる。
*5 炎症性サイトカイン
サイトカインは細胞間の情報伝達を担うタンパク質の総称であり、炎症性サイトカインは生体内におけるさまざまな炎症を促進する。
*6 GM-CSF (Granulocyte-macrophage Colony Stimulating Factor、顆粒状マクロファージコロニー刺激因子)
ILC3などの細胞から産生され、サイトカインとして機能する。自然免疫系の恒常性維持にはたらくが、近年、自己免疫疾患や炎症性疾患の発症において重要な役割を果たすことが示唆されている。
*7 タイトジャンクション
腸管などの上皮細胞に局在する細胞間接着構造で、隣接する細胞どうしをClaudinなどの接着分子によって密接に結合させる。これによりバリアが形成され、組織内への腸内細菌や異物などの侵入を防ぐ。
*8 STAT5 (Signal Transducer and Activator of Transcription 5)
転写因子の一つで、サイトカイン等の刺激に応じて活性化されると、核内に移行して遺伝子の発現を制御する。
*9 トル様受容体 (Toll-like Receptor、TLR)
パターン認識受容体の一つで、細菌やウイルスなどの特徴的な構造を認識して感染防御反応を誘導する。
論文情報
雑誌名
Cell Reports
論文タイトル
Blocking DCIR mitigates colitis and prevents colorectal tumors by enhancing the GM-CSF-STAT5 pathway
著者
Haiyang Sun, Ce Tang, Soo-Hyun Chung, Xiao-Qi Ye, Yulia Makusheva, Wei Han, Masato Kubo, Shigeyuki Shichino, Satoshi Ueha, Koji Matsushima, Kazuho Ikeo, Masahide Asano, and Yoichiro Iwakura
DOI
研究室
岩倉研究室のページ:https://www.rs.tus.ac.jp/iwakuralab/
岩倉教授のページ:https://www.tus.ac.jp/academics/teacher/p/index.php?657F
東京理科大学について
東京理科大学:https://www.tus.ac.jp/
詳しくはこちら
