ニュース&イベント NEWS & EVENTS
シアル酸除去による関節リウマチや多発性硬化症等の治療
~骨代謝系と免疫システムを抑制する新たな制御機構の解明~
学校法人 東北医科薬科大学
東京理科大学
研究のポイント
- 今回、私たちはアシアロ二本鎖N型糖鎖注1がヒトおよびマウスDCIR注2のスイッチ物質(機能的リガンド)であることを初めて発見しました。
- DCIRとアシアロ二本鎖N型糖鎖の相互作用は、骨を破壊する破骨細胞注3の形成を減少させること、樹状細胞注4の抗原提示機能を低下させ過剰な生体応答を抑制させることが明らかになりました。
- 実験動物にノイラミニダーゼ注5を投与してシアル酸を除去すると、実験的自己免疫疾患の臨床症状が改善されることを見出しました。
- 本研究の成果は関節リウマチや多発性硬化症等のヒトの自己免疫疾患の病態理解と治療法開発に貢献すると期待されます。
研究概要
DCIRは樹状細胞や破骨細胞で発現している受容体型の蛋白質ですが、これらの細胞の機能を制御していることが知られています。東京理科大学生命医科学研究所実験動物学研究部門の岩倉 洋一郎(いわくら よういちろう)教授らの研究グループは、N型糖鎖末端のシアル酸修飾がないアシアロ二本鎖N型糖鎖がヒトおよびマウスDCIRの機能的リガンド(スイッチとして働く物質)であり、アシアロ二本鎖N型糖鎖とDCIRの相互作用は、樹状細胞の働きと破骨細胞の形成を抑制することを明らかにしました。また、実験動物にシアル酸を遊離させる糖加水分解酵素ノイラミニダーゼを投与することにより、実験的関節炎や実験的自己免疫性脳脊髄炎のような自己免疫疾患が改善されることを発見しました。本研究の成果は、糖鎖末端の修飾変化が免疫システムと骨代謝系の制御に関与しており、DCIRへの入力を増強することによって自己免疫疾患や骨疾患を治療できることを示しており、DCIRあるいはアシアロ二本鎖N型糖鎖を標的とした免疫・骨代謝疾患の新規治療法の開発に役立つことが期待されます。本研究成果は令和3年11月25日(木曜日)付け(米国東部標準時:令和3年11月24日(水) 10:00)に国際専門誌 Journal of Experimental Medicine誌のオンライン版に掲載されました。本研究は、JST戦略的創造研究推進事業CREST(105100000222)、日本医療研究開発事業AMED(16809407)、JSPS科研費(24220011、20H04954、23500489)の助成を受けて行われました。
研究背景
関節炎の発症に関連する遺伝子として同定したDCIRは、細胞外領域に糖鎖認識領域、細胞内に抑制性の調節領域であるITIM注6を持つ膜タンパク質です。DCIRはC型レクチン受容体注7と呼ばれる分子のひとつで、樹状細胞や破骨細胞等に発現します。我々は、独自に作製したDcir欠損マウスが自己免疫疾患様症状や骨量増加を示すことから、DCIRが免疫システムと骨代謝系を制御する生体システムの重要な抑制性受容体であることを明らかにしております。しかしながら、受容体からのシグナルを引き起こすためのスイッチ役となる機能的リガンドは不明のままでした。
研究内容
本研究では、DCIRの機能的リガンドを同定するために高感度糖鎖アレイ法注8を用いてマウスに発現するDCIRの機能的リガンドを探索しました。その結果、マウスDCIRはアシアロ二本鎖N型糖鎖に結合することを発見しました(図1a)。また、ヒトに発現するDCIRも同じ糖鎖に結合しました。マウスの細胞を使用した破骨細胞誘導の実験過程にアシアロ二本鎖N型糖鎖を添加すると破骨細胞の形成が抑制され、DCIRを欠損した細胞では抑制効果が認められないことから、アシアロ二本鎖N型糖鎖は機能的なDCIRリガンドであることが示されました(図1b)。ヒトの破骨細胞誘導系でも同じ結果が示され、アシアロ二本鎖N型糖鎖はヒトDCIRの機能的リガンドであることも分かりました。このDCIRとアシアロ二本鎖N型糖鎖の相互作用が、個体内で作用しているのかを調べるために、ノイラミニダーゼをマウスに投与して実験的免疫疾患モデル(CIA、EAE) 注9,10を誘導すると臨床症状が改善されることを見出しました(図1c)。このときDCIRとアシアロ二本鎖N型糖鎖の相互作用が樹状細胞の抗原提示機能を抑制し、T細胞応答が減弱することが示されました。
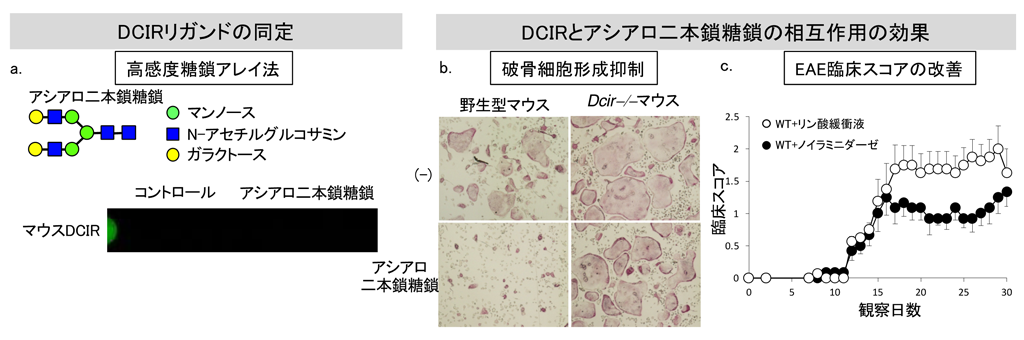
図1. 研究結果内容.
a. DCIRリガンドの同定。糖鎖アレイ法を用いてDCIRとアシアロ二本鎖N型糖鎖との結合を検出した。
b. 破骨細胞誘導系にアシアロ二本鎖糖鎖を添加した。野生型マウス由来細胞において破骨細胞形成が抑制された。
c. ノイラミニダーゼを投与後にEAEを誘導した。ノイラミニダーゼ投与群においてEAEの臨床症状が有意に改善した。
展望
今回の研究では、DCIRはアシアロ二本鎖N型糖鎖を認識し、DCIRとアシアロ二本鎖N型糖鎖の相互作用が樹状細胞の働きと破骨細胞の形成を調節することを発見しました(図2)。糖鎖末端に付加されたシアル酸は生体システムにおいて様々な作用をすることが知られていますが、DCIRはその糖鎖末端の構造変化を認識し過剰な細胞応答を抑制するという糖鎖と免疫システムの新しい仕組みが示されました。今後の糖鎖生物学と免疫学の研究発展に貢献することが期待されます。また、ヒトDCIR遺伝子は関節リウマチに関連していることが示されていることから、ヒトDCIRとアシアロ二本鎖N型糖鎖は自己免疫疾患に対する新規の治療標的となることが期待されます。
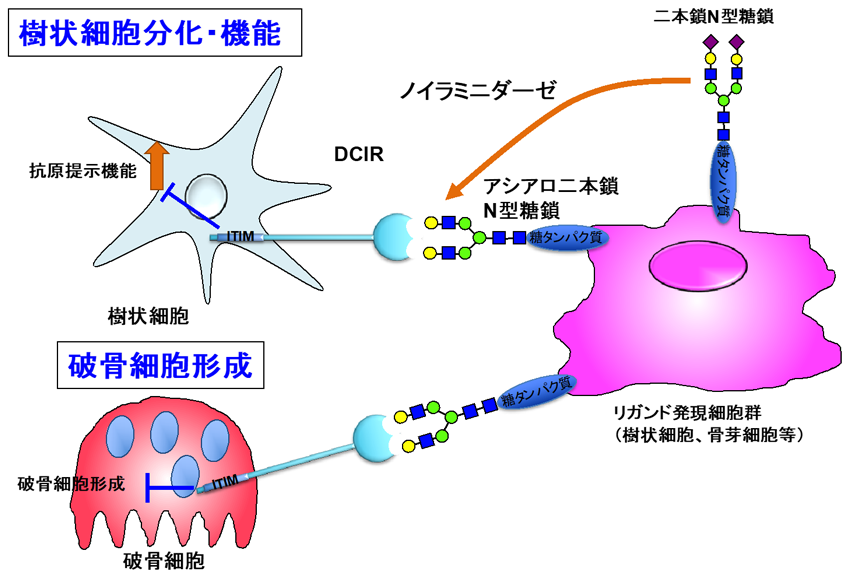
図2. DCIRとアシアロ二本鎖N型糖鎖の相互作用による樹状細胞機能と破骨細胞形成を抑制するメカニズム.
ノイラミニダーゼによりシアル酸を除去された二本鎖N型糖鎖とDCIRが結合すると、樹状細胞や破骨細胞に抑制のシグナルを伝達する。DCIRは細胞内に抑制の調節をする領域にITIMを持つ。
用語説明
注1. アシアロ二本鎖N型糖鎖:ガラクトースが露出した二本鎖N型糖鎖(図1a)。
注2. DCIR:Dendritic Cell ImmunoReceptor (樹状細胞免疫受容体)は抑制シグナルを惹起するC型レクチン受容体で、樹状細胞、マクロファージ等のミエロイド系細胞に発現。
注3. 破骨細胞:関節炎や骨再構築の過程において骨を破壊する(吸収する)役割を担う細胞。
注4. 樹状細胞:白血球の一種で、異物を取り込みT細胞に抗原提示することで、免疫反応の開始や免疫システムの維持を制御する細胞。
注5. ノイラミニダーゼ:糖鎖の末端に結合したシアル酸を切断除去する糖加水分解酵素。この酵素の処理によりアシアロ糖鎖を露出させることが可能。
注6. ITIM: Immunoreceptor Tyrosine-based Inhibitory Motifの略。リン酸化されたチロシンにフォスファターゼ(SHP-1/2)が結合することで抑制性シグナルを惹起する。
注7. C型レクチン受容体:真菌や細菌の特徴的な構造を認識して感染防御反応を誘導する膜貫通型タンパク質で、活性化シグナルを惹起する受容体と抑制性シグナルを惹起する受容体が知られている。しかし、一部のC型レクチン受容体は生体防御以外の機能を果たすことが最近わかってきた。
注8. 糖鎖アレイ:100種類以上の合成糖鎖がスポットされたガラススライドを利用して、糖鎖と糖鎖認識分子との結合を網羅的に検出する方法。蛍光物質をプローブに使用することで高感度検出が可能。
注9. CIA:Collagen-Induced Arthritis、コラーゲンタンパク質をマウスに免疫して誘導する自己免疫性関節炎モデル。ヒト関節リウマチの動物モデルとして利用される。
注10. EAE: Experimental Autoimmune Encephalomyelitis、ミエリンオリゴデンドロサイト糖タンパク質をマウスに免疫して誘導する実験的自己免疫性脳脊髄炎モデル。自己応答性T細胞に依存的に中枢神経系に慢性炎症を引き起こす。ヒト多発性硬化症の動物モデルとして利用される。
論文情報
論文題目
DCIR and its ligand asialo-biantennary N-Glycan regulate DC function and osteoclastogenesis.
(DCIRとそのリガンドであるアシアロ二本鎖N型糖鎖は樹状細胞機能と破骨細胞形成を制御する。)
掲載誌名
Journal of Experimental Medicine, 2021
DOI
著者名
Kaifu T*, Yabe R*, Maruhashi T*, Soo-Hyun Chung*, Tateno H, Fujikado N, Hirabayashi J, Iwakura Y (*equal contributor).
責任著者
岩倉洋一郎(東京理科大学生命医科学研究所)
海部知則(東北医科薬科大学医学部免疫学教室講師)、矢部力朗(現千葉大学真菌センター)、丸橋拓海(現東京大学定量生命科学研究所助教)、鄭スーヒョン(東京理科大学生命医科学研究所助教)の4名は同等にこの研究に寄与した。
お問い合わせ先
【研究に関すること】
東北医科薬科大学 医学部 免疫学教室
講師 海部知則
電話番号:022-290-8726
Eメール : kaifu【@】tohoku-mpu.ac.jp
【@】は@にご変更ください。
【報道に関すること】
学校法人 東北医科薬科大学 広報室
担 当:関根幸世
電話番号:022-727-0357(内線2371)
FAX番号:022-275-2383
研究室
岩倉研究室のページ:https://www.rs.tus.ac.jp/iwakuralab/
岩倉教授のページ:https://www.tus.ac.jp/academics/teacher/p/index.php?657F
東京理科大学について
東京理科大学:https://www.tus.ac.jp/
詳しくはこちら
