ニュース&イベント NEWS & EVENTS
優れた抗がん作用を示すトリプチセン-ペプチドハイブリッド化合物の創製に成功
~プログラム細胞死誘導機構の解明に大きく寄与~
研究の要旨とポイント
- 多細胞生物の機能であるプログラム細胞死(※1)にはさまざまな誘導機構があり、その反応の詳細については未解明な部分が多く残されていました。
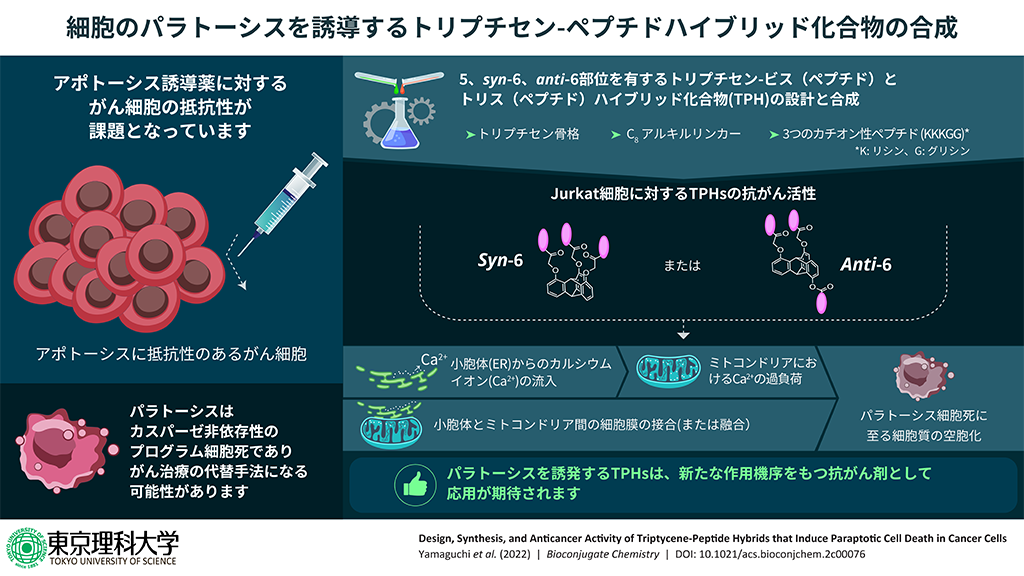
- 新たに3種類のトリプチセン-ペプチドハイブリッド化合物(TPHs)を合成し、これらが優れた抗がん作用を示すことを実証しました。
- 細胞内でのTPHsと阻害剤の反応を細かく追跡することにより、プログラム細胞死の1種であるパラトーシス(※2)が誘発される機構を解明しました。
- 本研究成果により、プログラム細胞死の全容解明や新たな抗がん剤開発への貢献が期待されます。
東京理科大学薬学研究科薬科学専攻の山口晃平氏(2022年3月修士課程修了)、横井健汰博士(2022年3月博士課程修了、現在同大学薬学部生命創薬科学科ポストドクトラル研究員)、同大学薬学部生命創薬科学科の青木伸教授らの研究グループは、主骨格であるトリプチセンに複数のペプチド鎖を導入した新規ハイブリッド化合物(TPHs)を合成し、これらの化合物がJurkat細胞(※3)に対して強く作用し、パラトーシスを誘導することを明らかにしました。また、これらの細胞内での作用をより詳しく調査することで、パラトーシスが誘導されるメカニズムを解明することに成功しました。本研究をさらに発展させることで、特定の細胞を選択的に細胞死させる技術につながり、がんを始めとするさまざまな病気の治療薬への貢献が期待されます。
本研究グループは過去に、イリジウム(III)錯体-ペプチドハイブリッド化合物(IPHs)を合成し、この化合物がJurkat細胞のパラトーシスを誘発することを見出していました。今回、パラトーシス誘導機構の理解をより一層深めるため、過去の知見を活かした新たな分子設計を行い、実際の合成および機能評価を行いました。
今回合成したTPHsはIPHsとは異なる主骨格を有していますが、IPHsと類似したパラトーシスを引き起こし、IPHsよりも優れた抗がん作用を示すことがわかりました。また、小胞体とミトコンドリア間のカルシウムイオンの直接的な輸送が深く関与することなど、パラトーシスに至る反応の詳細を解明しました。これらの成果は、プログラム細胞死の全容を明らかにする上で非常に重要な知見であり、医療分野での応用が大いに期待されます。
本研究の成果は、2022年4月11日に国際学術誌「Bioconjugate Chemistry」にオンライン掲載されました。
研究の背景
プログラム細胞死は多細胞生物が生命を維持するために必要な機能の1つで、アポトーシス、ネクロトーシス、オートファジー、パラトーシスなどのさまざまな種類があることが知られています。特に、パラトーシスについては原因となるメカニズムなど未解明な部分が多く、このプロセスをより深く理解することで、がんなどの治療のための新しい戦略につながる可能性があります。
本研究グループは過去に高い抗がん作用とがん細胞選択性を有するIPHsを合成すると同時に、IPHsがJurkat細胞に作用してパラトーシスを誘導する一連のプロセスについて報告し、世界的な評価を受けています(*1)。そこで今回、パラトーシス誘導機構をより詳細に明らかにするため、IPHsとは分子構造が大きく異なる3種類のTPHsを合成し、それらの機能評価と作用機序の解明を行いました。
(過去のニュース&イベント)
*1: 本学教員・大学院生らの学術論文が、アメリカ化学会『Biochemistry』誌のSupplementary Cover Artに選定
URL: https://www.tus.ac.jp/today/archive/20220428_5982.html
研究結果の詳細
最初に、ペプチド鎖の数や配向が異なる3種類のTPHs(ビスペプチド、 syn-型トリスペプチド、anti-型トリスペプチド)の合成を行いました。そして、Jurkat細胞に対する細胞毒性試験を行い、IPHsの結果と比較しました。各化合物のEC50値(※4)は、IPHsで5.0 μM、ビスペプチドで2.4 μM、syn-型トリスペプチドで1.9 μM、anti-型トリスペプチドで2.9 μM であることがわかりました。これにより、3種類のTPHs全てがIPHsよりも高い抗がん作用を示すことが示唆されました。
次に、syn-型トリスペプチドまたはanti-型トリスペプチドと各阻害剤を反応させ、顕微鏡による細胞観察を行いました。その結果、アポトーシス、ネクロトーシス、オートファジーとは異なる細胞死が誘発されること、それがIPHsのパラトーシスと酷似した細胞死であることがわかりました。これにより、IPHsと共通するペプチド鎖部位が大きく影響していることを確認できました。
最後に、カルシウムイオンが関与する細胞小器官やそれらのカルシウムイオン濃度を細かく調べました。その結果、小胞体からミトコンドリアへのカルシウムイオンの輸送とミトコンドリアの膜電位低下が誘起されていることがわかりました。これにより、各小器官でのカルシウムイオン恒常性のバランスが重要な因子であることが示唆されました。
本研究グループは全体の結果から、TPHsによる細胞死はおよそ以下①~④のプロセスで引き起こされると推定しました。
① TPHsによって、小胞体とミトコンドリア間の細胞膜の接合が誘導される。
② 小胞体からミトコンドリアへの直接的なカルシウムイオンの輸送が生じる。
③ ミトコンドリアの細胞膜電位が低下し、小胞体やリソソームの分解が生じる。
④ パラトーシスが誘発される。
今回の研究成果について、研究を主導した青木教授は「抗がん剤の多くはアポトーシス誘導活性を持っていますが、アポトーシス耐性を獲得したがん細胞に対しての効果が弱くなってしまうことが課題でした。本研究はアポトーシスとは異なる種類の細胞死誘導薬剤の開発につながる重要な成果であり、がんを始めとするさまざまな疾病に対する治療薬への応用が期待されます」と話しています。
※本研究は、文部科学省(17K08225, 18F18412, 20K05712)、公益財団法人上原記念生命科学財団、公益財団法人東京応化科学技術振興財団、公益財団法人東京生化学研究会による支援を受けて実施されました。
用語
※1 プログラム細胞死: 細胞内の遺伝的にコードされた機構により生じる細胞死。細胞膜や核などが損傷し、修復不可能となった状態の細胞死とは区別する。
※2 パラトーシス: プログラム細胞死の1つ。アポトーシス、ネクロトーシス、オートファジーとは異なる機構を有することが知られている。
※3 Jurkat細胞: ヒト白血病性がん細胞。薬剤や放射線に対してのがんの感受性を研究する際によく用いられる。
※4 EC50値: 50%効果濃度。薬物や抗体において、その作用が最大値の50%を示す濃度を表す。
論文情報
雑誌名
Bioconjugate Chemistry
論文タイトル
Design, Synthesis, and Anticancer Activity of Triptycene-Peptide Hybrids that Induce Paraptotic Cell Death in Cancer Cells
著者
Kohei Yamaguchi, Kenta Yokoi, Masakazu Umezawa, Koji Tsuchiya, Yasuyuki Yamada, and Shin Aoki
DOI
研究室
青木研究室のページ:https://www.rs.noda.tus.ac.jp/aokilab/
青木教授のページ:https://www.tus.ac.jp/academics/teacher/p/index.php?3f7d
東京理科大学について
東京理科大学:https://www.tus.ac.jp/
詳しくはこちら
