ニュース&イベント NEWS & EVENTS
蛍光タンパク質の蛍光強度を維持したまま組織・器官を透明化できる 動植物共通の透明化法開発に成功
~農作物の品種改良や脳の診断法開発に貢献~
東京大学
大阪大学
神戸大学
横浜市立大学
東京理科大学
1. 発表者:
坂本 勇貴 (大阪大学大学院理学研究科生物科学専攻 助教)
酒井 友希 (神戸大学大学院理学研究科生物学専攻 JSPS特別研究員)
西浜 竜一 (東京理科大学理工学部応用生物科学科 教授)
佐野 良威 (研究当時:東京理科大学理工学部応用生物科学科 助教)
古市 貞一 (東京理科大学理工学部応用生物科学科 嘱託教授)
辻 寛之 (横浜市立大学大学院生命ナノシステム科学研究科・木原生物学研究所 准教授)
河内 孝之 (京都大学大学院生命科学研究科 教授)
松永 幸大 (東京大学大学院新領域創成科学研究科先端生命科学専攻 教授)
2. 発表のポイント:
- ◆植物と動物の区別なく、組織や器官を透明化(注1)できる方法を開発しました。
- ◆この手法を用いて、従来法より蛍光タンパク質の蛍光強度を維持したままで透明化することに成功しました。
- ◆組織や器官深部の構造を維持したまま細胞を観察することができるため、器官形成や組織の成り立ちのメカニズム研究の加速、農作物の品種改良や脳の診断法開発への貢献が期待されます。
3. 発表概要:
厚みのある組織や器官の深部を観察するためには、内部での光の反射・散乱・吸収を防ぎ、光の直進性を維持することが大切です。生物の組織・器官はさまざまな物質を含むため、そのままの状態で内部構造を知ることは困難です。そこで、組織や器官を光が通過できるように透明化する方法が開発されてきました。ところが、植物と動物では組織や器官に含まれる物質が異なるため、手法も別々でした。
大阪大学大学院理学研究科の坂本勇貴助教、東京大学大学院新領域創成科学研究科の松永幸大教授ら、植物や動物の器官や組織を研究する共同研究グループは、動植物共通の組織・器官透明化法iTOMEI (improved Transparent Organ Method for Imaging)の開発に成功しました。従来の透明化方法の各ステップを綿密に見直し、改良を実施することで、蛍光タンパク質の蛍光強度を維持したままで、動植物の組織や器官を透明化できるようになりました。
この透明化手法の開発により、生物の組織・器官の内部構造を動物・植物を区別することなく研究できるようになり、生物共通の器官形成や組織の成り立ちのメカニズムの理解に貢献することが期待されます。
本研究成果は、2022年1月10日付けで国際科学雑誌「Communications Biology」のオンライン版に掲載されました。
本研究は、文部科学省科学研究費・新学術領域「不均一環境変動に対する植物のレジリエンスを支える多層的情報統御の分子機構」(20H05911)、「植物の生命力を支える多能性幹細胞の基盤原理」(20H04884)、基盤研究B(19H03259、20H03297)、基盤研究C(21K06247)、若手研究(18K14743)、三菱財団自然科学研究助成などのもとで実施されました。
4. 発表内容:
切片を作製することなく内部構造の顕微鏡観察が可能となる組織や器官の透明化方法は、植物用もしくは動物用として別々に開発されてきました。それは、植物と動物では組織や器官に含まれる物質が異なるためです。例えば、植物には細胞壁がありクロロフィルを含む葉緑体がありますが、動物にはありません。ほかにも植物および動物特有の物質が含まれるため、透明化試薬は別々に開発されて研究に用いられてきました。
組織や器官におけるタンパク質の発現場所を調べるために、蛍光タンパク質を用いた蛍光イメージングが盛んに行われてきました。従来の透明化手法では、対象が植物の場合に、透明化処理を行うと、蛍光タンパク質の蛍光が弱くなる問題点がありました。今回、透明化方法の各ステップを綿密に見直し、改良を実施することで、従来法よりも蛍光タンパク質の蛍光強度を維持したままで、動植物の組織や器官を透明化できるようになりました。
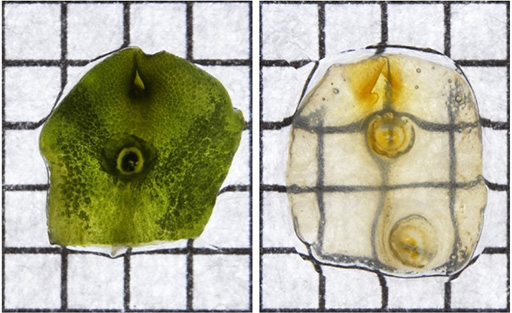
自家蛍光を持つクロロフィルが含まれる葉緑体は、植物の組織や器官をイメージング解析する際に大きな観察障害となっていました。この自家蛍光を除去するために、複数の界面活性剤を検証したところ、カプリリルスルホベタイン(注2)によりクロロフィル色素由来の自家蛍光を除去することができました。また、カプリリルスルホベタイン処理を行っても、植物の中で発現させた蛍光タンパク質の蛍光強度にはほとんど影響はありませんでした。この手法により、葉緑体を持つ組織の内部構造を三次元的にイメージング解析することができるようになり、植物組織深部の細胞で発現している蛍光タンパク質の解析も可能になりました。
また、組織や器官の固定を行う際に、蛍光タンパク質の蛍光強度が減少することが知られています。この問題を解決するために、固定した組織や器官に対して、弱いアルカリ処理を施すことで蛍光タンパク質の蛍光強度を回復させることができました。この回復した蛍光強度は透明化処理をした後も維持されていました。また、顕微鏡観察時に用いる封入剤(注3)としては、コンピュータ断層撮影(CTスキャン)の造影剤として使用されるイオヘキソールが最適であることがわかりました。
今回の研究成果により、イネ、シロイヌナズナ、ゼニゴケなどの植物組織・器官を、蛍光タンパク質の蛍光強度を維持したまま27時間以内に透明化することが可能になりました(図1、2)。例えば、イネの根の中央部にある水の通り道・原生木部で発現するタンパク質も、切片を作らず解析できました。また、これまで切片を作って解析していたゼニゴケの葉状体についても、iTOMEIにより透明化することで、切片を作らずに深部の細胞で発現している蛍光タンパク質を解析できました。
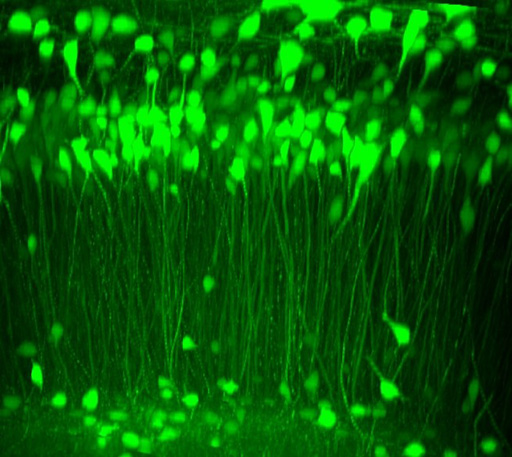
さらに、iTOMEI法をマウスの脳の透明化に適用したところ、48時間以内に、透明化することができました(図3)。この透明化した脳を用いて蛍光タンパク質の検出を顕微鏡で行ったところ、大脳皮質表面から3 mmの深さにある細胞に局在する蛍光タンパク質を検出することができました。加えて、海馬と大脳皮質の細胞体、軸索、樹状突起における蛍光タンパク質の蛍光も明瞭に検出できました(図4)。
iTOMEI法により、別々の方法で行われていたさまざまな組織や器官の透明化を、動植物共通の方法で解析することが可能になりました。個々の細胞の形態から組織・器官の構造解析が可能になることから、今後、農作物の品種改良や脳の診断開発などの分野に貢献することが期待されます。
5. 発表雑誌:
雑誌名
Communications Biology(オンライン版:1月10日)
論文タイトル
Improved clearing method contributes to deep imaging of plant organs
著者
Yuki Sakamoto, Anna Ishimoto, Yuuki Sakai, Moeko Sato, Ryuichi Nishihama, Konami Abe, Yoshitake Sano, Teiichi Furuichi, Hiroyuki Tsuji, Takayuki Kohchi, and Sachihiro Matsunaga
DOI
6. 用語解説:
(注1)透明化
組織・器官はさまざまな物質を含むために、光が直進することができず、反射・散乱により内部構造を解析することはできない。組織や器官を透明化することで、深部まで光が直進し、内部構造を顕微鏡観察できるようになる。そのため、動物や植物の組織・器官を透明化する手法が開発されてきた。
(注2)カプリリルスルホベタイン(別名:デシルジメチル(3-スルホプロピル)アンモニウムヒドロキシド分子内塩)
界面活性剤の一種。今まで透明化試薬に使用されたことはなかった。葉緑体のクロロフィル色素の自家蛍光を除去するが、蛍光タンパク質の蛍光を減衰させることはないことを発見した。
(注3)封入剤
顕微鏡観察する時に、最終的にサンプルを浸す緩衝液のこと。
7. 添付資料:


研究室
西浜研究室のページ:https://www.rs.tus.ac.jp/nishihama/
西浜教授のページ:https://www.tus.ac.jp/academics/teacher/p/index.php?7426
東京理科大学について
東京理科大学:https://www.tus.ac.jp/
詳しくはこちら
