ニュース&イベント NEWS & EVENTS
微小環境の変化に応答して薬物放出するハイドロゲルの簡便な調製方法の開発に成功
~より効果的に標的部位に薬剤を送達できるがん治療技術への応用に期待~
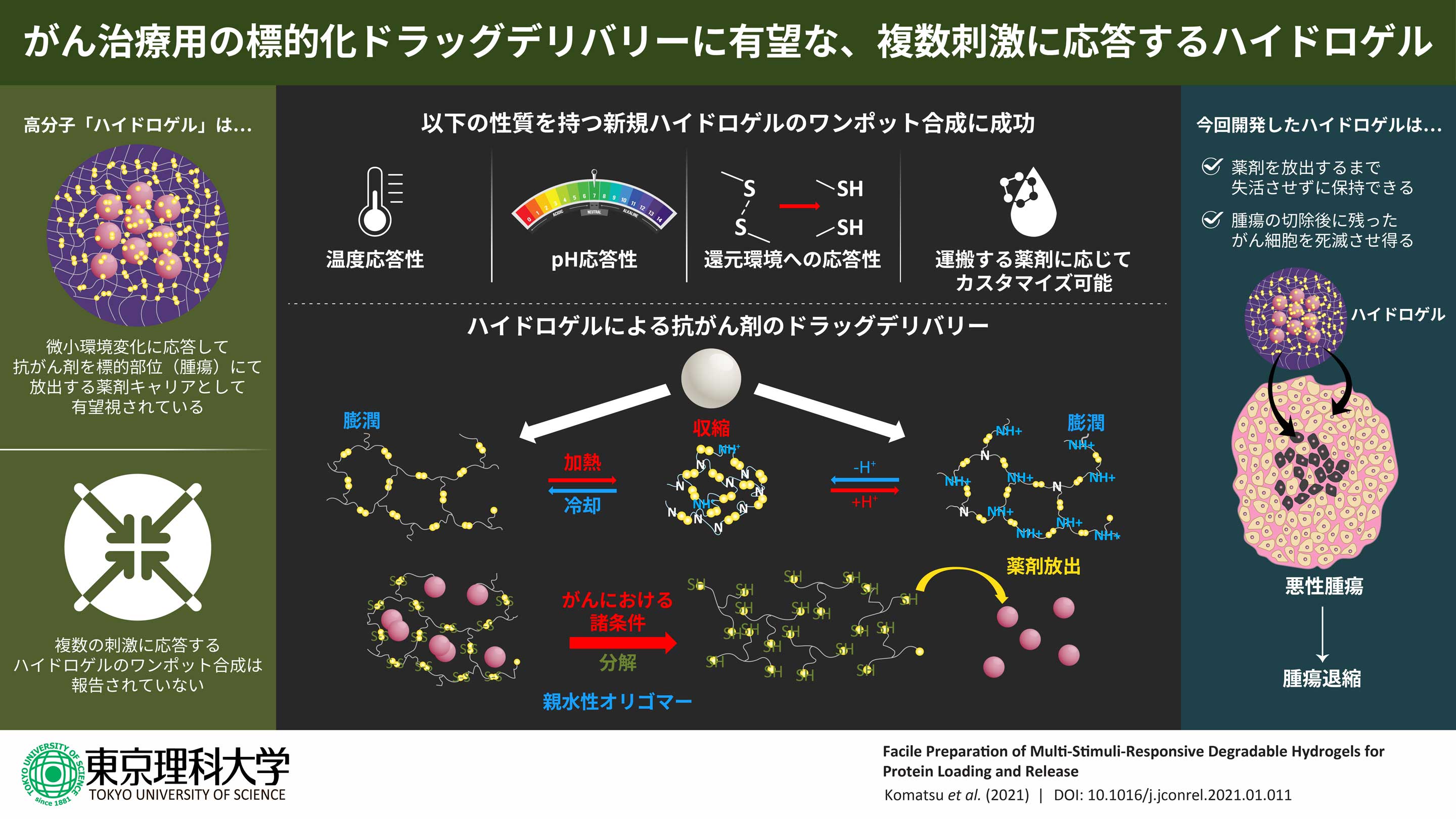
- ●ハイドロゲルは水を多く含み、様々な刺激に対して応答する機能を持つように設計できることから、がん治療におけるドラッグデリバリーシステムのキャリアとして有望視されています。
- ●本研究では、温度、pH、還元環境に応答するハイドロゲルを簡単に調整できる方法を開発しました。
- ●本ハイドロゲルは温度変化に伴うゲルの膨潤と収縮を利用して、がんの微小環境を模倣した還元環境下で内包した分子を放出することから、がん治療におけるドラッグデリバリーキャリアとして有望であると期待されます。
東京理科大学基礎工学部材料工学科(現 先進工学部マテリアル創成工学科)の菊池明彦教授、小松周平助教、多湖萌野氏(2019年度修士課程修了)、安藤祐氏(2016年度修士課程修了)、大阪大学大学院工学研究科応用化学専攻の麻生隆彬准教授の研究グループは、温度、pH、還元環境に応答するハイドロゲルの簡便な調製方法の開発に成功しました。本ハイドロゲルは温度変化に伴うゲルの膨潤と収縮を利用して、内包した薬物をがんの微小環境を模倣した還元環境下で放出します。
がん細胞だけに直接抗がん剤を届ける運搬体(キャリア)を設計するためには、酸性環境もしくは還元環境で特徴付けられるがん細胞に由来する微小環境を認識できる機能性材料が必要となります。ハイドロゲルは水を多く含み、刺激に対して応答する機能を持つよう設計できることから、ドラッグデリバリーシステムにおけるキャリアとして有望視されています。しかしながら、複数の刺激に応答する機能と分解性を併せ持つゲルを簡便に作製することは困難です。
今回、研究グループはポリ(エチレングリコール)ジグリシジルエーテル(PEGDE)−シスタミン間のカップリング反応によって、温度とpH、還元環境に応答するハイドロゲルをワンポット合成(※1)で調製しました。このハイドロゲルは、架橋剤であるシスタミンから生じた第二級もしくは第三級アミノ基のプロトン化によってpH低下に応答した膨潤挙動と、加熱すると徐々にハイドロゲルは収縮し、降温すると再び膨潤する温度応答挙動を示します。 また、本ハイドロゲルは、ジチオトレイトールもしくはグルタチオンが存在する還元環境ではチオール交換反応を介して分解されます。蛍光標識したモデルタンパク質のローディング(内包)特性を調べた結果、分子量もしくは流体力学的半径(※2)が小さくなるほど内包されるタンパク質の量は多くなることがわかりました。これは、ハイドロゲルのネットワーク構造の網目サイズによるものと考えられます。ハイドロゲルに内包されたタンパク質は、正常細胞を模倣したpH7.4、37℃の環境下ではほとんど放出されなかったのに対し、がんの微小環境を模倣した還元環境下で、ハイドロゲルの分解にともなって放出されました。
以上の結果から、本研究で作製したハイドロゲルはがん微小環境下で薬物放出を行うドラッグデリバリーシステムのキャリアとして有望であると期待されます。
本研究は国際科学誌『Journal of Controlled Release』の3月10日号に掲載され、掲載号のInside Front Coverに選出されました。
 |
【研究の背景】
タンパク質やペプチド、オリゴヌクレオチドを含む生物学的製剤は、細胞やウイルス、バクテリアなどの生物由来の薬剤で、がんなどの生死に関わる疾患の治療薬として使われています。しかしながら、生物学的製剤はターゲットに到達する前に変性や失活が起こるリスクがあります。そのため、薬物分子を変性させずに内包、運搬するとともに、ターゲットとなる組織で放出するドラッグデリバリーシステム(DDS)キャリアが求められています。
ハイドロゲルは3次元的なネットワーク構造を持ち、水を比較的多く含む生物の組織に類似した構造であることから、内包されたタンパク質、ペプチド、オリゴヌクレオチドの変性を抑制できます。さらに、分子デザインによってはpHや温度に対する応答性や生分解性などの特性を発現させることができます。現在までに、DDSキャリア候補としてさまざまな物理化学的刺激に応答するハイドロゲルが報告されています。しかし複数の刺激に応答するハイドロゲルを合成するためには、複数段階の化学反応が必要となります。それに加え、実際の生体内環境下で起こると想定される刺激に対して適切に応答することも、DDSキャリアとして応用する上では必須です。
がんの微小環境は、がん組織には正常組織よりも低酸素状態、かつ解糖系の亢進のためグルコースが代謝されて乳酸とプロトンが放出されるためpHが低下します。さらにグルタチオンの濃度が高いことから、局所的なpHと還元環境に対する応答能を持つハイドロゲルは、DDSキャリアとしての応用が期待されます。
研究グループはこれまでに、酸化還元反応に応答する三分岐型オリゴ(エチレングリコール)(trisOEG)ハイドロゲルの調製に成功しています。trisOEGハイドロゲルは3つのアームを持ち、ジルスフィド結合で架橋されている分子量の低いオリゴ(エチレングリコール)から形成させるため、メッシュサイズを制御することができ、分解酵素からタンパク質を守ることができます。このハイドロゲルは還元剤であるグルタチオンやジチオトレイトールによって分解されると、内包されていたタンパク質が速やかに放出されます。それに加え、研究グループはジスルフィド結合で分子間架橋されたtrisOEGでできた、温度と酸化還元反応に応答するポリマーの合成も報告しています。温度に対する応答特性は、疎水性と親水性のバランスとポリマーの化学構造によって決まります。ポリマーの水溶性はtrisOEGとシスタミンの化学組成を変化させることで調節できます。しかしながら、複数の刺激に応答し、分解特性も有するハイドロゲルの調製は複数ステップの化学反応が必要で、これまでにワンポット合成で作製した報告はありません。そのため、複数の刺激に応答するハイドロゲルの簡単な調製方法の開発が求められています。
そこで研究グループは、温度、pH、酸化還元反応に応答するハイドロゲルをワンポット合成する方法を開発することを目的に研究を行いました。
【研究結果の詳細】
研究グループは、酸化還元反応に応答するジスルフィド結合と、pHに反応するアミノ基を導入するために、PEGDEのエポキシドとシスタミンのアミノ基のエポキシ開環反応を介して、複数の刺激に対して反応性を持つハイドロゲルを調製しました。合成反応時のPEGDEとシスタミンのモル比率と、PEGDE濃度の両方がゲル化挙動に影響を与えました。PEGDEのエポキシ基と反応したシスタミンは第二級アミンとなり、このアミノ基はさらに他のエポキシ基と反応して第三級アミンとなると同時に、三次元架橋構造を有するハイドロゲルのネットワーク構造を形成します。そのため、シスタミン量が相対的に上昇することにより、ハイドロゲルのネットワーク形成が不十分になり、カップリング反応後のゲル化が全く起こらない、あるいは不十分なゲル化が起こります。以上を踏まえ、ハイドロゲルの調製条件はPEGDE濃度が30-50wt%、PEGDE:シスタミンのモル比が1.5:1.0以上であることがわかりました。以下の実験では、PEGDE濃度30wt%、PEGDE:シスタミンのモル比が2.0:1.0で調製したハイドロゲルを用いました。
次に、調製されたハイドロゲルのpH依存的な膨潤挙動を解析しました。本ハイドロゲルは前述の通り、PEGDEの架橋部に第三級あるいは第二級アミノ基を有します。37℃において、ハイドロゲルはpH5.4では膨潤、pH7.4のときに収縮することが確認されました。これは、ハイドロゲル中のアミノ基はpKaを6.2に有し、低pH環境下でプロトン化され、プロトン化されたアミノ基は互いに静電反発し分子鎖が広がるとともに、より多くの水分子がハイドロゲル中に保持されるためです。pHに依存したハイドロゲルの膨潤度の変化を評価したところ、pH6.2程度を境に高pH側でアミノ基の脱プロトン化とそれに伴う脱水により膨潤度は2程度まで低下することがわかりました。pH6.2以下の酸性条件下では、シスタミン由来の第三級アミノ基がプロトン化されることで膨潤度が上昇しました。
同様に温度依存的な膨潤挙動を調べた結果、温度が高くなるにつれハイドロゲルは収縮することがわかりました。このハイドロゲルは末端がシスタミンと結合した親水性の短鎖PEGで構成されるため、PEG断片の分子運動性が制限されます。その結果、PEG鎖の水和が低下して温度依存的な膨潤挙動が生じます。
本ハイドロゲルは、ジチオトレイトールもしくはグルタチオンが存在する場合、還元環境下ではチオール交換反応により分解しました。以上より、複数刺激に応答して膨潤挙動や分解挙動を生起するハイドロゲルが調製できたことが明らかになりました。
蛍光標識したモデルタンパク質の内包特性を調べた結果、分子の拡散はハイドロゲルのメッシュサイズに依存することから、分子量もしくは流体力学的半径が小さいほど内包されるタンパク質の量は多くなりました。低温で膨潤したハイドロゲルにタンパク質を含浸させ、37℃でハイドロゲルを収縮させて安定に内包した蛍光標識タンパク質は、pHが5.4になってもほとんど放出されませんでした。pH5.4でタンパク質が放出されなかったのは、タンパク質とプロトン化したハイドロゲルとの静電相互作用が影響するためと考えられます。一方、還元環境下でのみ、ハイドロゲルの分解にともなってすべてのタンパク質が放出されました。
これらの結果から、本研究でワンポット合成により調製されたハイドロゲルは多種刺激に応答することが明らかになりました。さらに、がんの微小環境変化に応答することから、がん治療におけるDDSキャリアとして有望だと考えられます。特に、がんの切除後、患部に本材料を留置することで微小環境に応答して内包した薬物を放出することにより、残存がん細胞を除去しうる可能性があり、より強力な治療ツールになり得ます。
【用語】
※1 ワンポット合成:一つの反応容器に反応物を順に投入することで、多段階の反応を行う技術。
※2 流体力学半径:流体力学的に等価な球の半径。ストークス半径ともいう。
【論文情報】
- 雑誌名
- Journal of Controlled Release
- 論文タイトル
- Facile preparation of multi-stimuli-responsive degradable hydrogels for protein loading and release
- 著者
- Syuuhei Komatsu, Moeno Tago, Yu Ando, Taka-Aki Asoh, Akihiko Kikuchi
- DOI
- 10.1016/j.jconrel.2021.01.011
菊池研究室
研究室のページ:http://kikuchilab.com/home/
菊池教授のページ:https://www.tus.ac.jp/academics/teacher/p/index.php?1393&ls=gk
東京理科大学について
東京理科大学:https://www.tus.ac.jp/
詳しくはこちら
