ニュース&イベント NEWS & EVENTS
がんや免疫疾患に重要なPD-L2の発現制御機構の解明
~免疫細胞における細胞表面分子PD-L2は転写因子によって協調的に制御される~
- ●細胞表面分子PD-L2は様々ながんに関わっていることが知られているPD-1のリガンド分子ですが、その発現制御機構はよくわかっていませんでした。
- ●本研究ではPD-L2の遺伝子発現において、転写因子PU.1が、パートナー分子IRF4と協調的な転写活性化を行うこと、また、PU.1を介してヒストンアセチル化酵素が働いてエピジェネティック制御も行うことを明らかにしました。
- ●これらの分子はがんなどの疾患の治療薬のターゲット分子となる可能性があり、本研究を発展させることで、免疫の抑制機能を効率よく調節する手法の開発につながると期待されます。
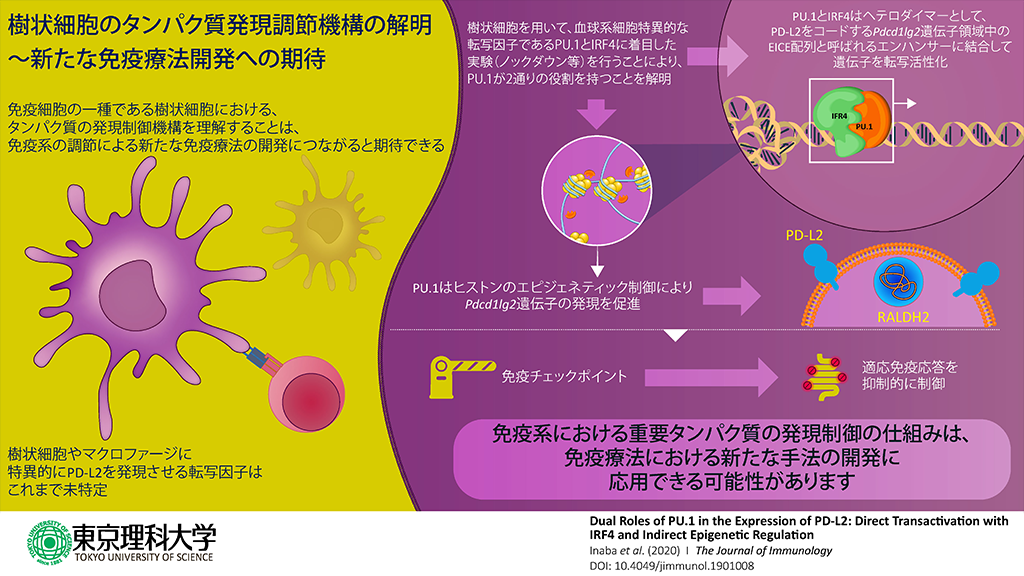 |
東京理科大学基礎工学部生物工学科の西山千春教授らの研究グループは、免疫細胞に特徴的に発現する細胞表面分子PD-L2の遺伝子発現制御機構を明らかにしました。
PD-1(Programmed cell death 1)は免疫T細胞の表面にある受容体であり、そのリガンドはPD-L1とPD-L2です。これらの分子はがんや免疫疾患に関わっており、治療薬のターゲット分子として注目されています。PD-L2は樹状細胞などの特定の細胞種に発現することがわかっていますが、その発現機構はわかっていませんでした。そこで、本研究グループは、クロマチン免疫沈降アッセイ(ChIPアッセイ:※1)やフローサイトメトリー、定量的PCRなどを駆使してPD-L2遺伝子の発現制御機構を調べました。
その結果、PD-L2遺伝子の発現は転写因子であるPU.1とインターフェロン制御因子-4(IRF4)のヘテロダイマーによって制御されることがわかりました。その制御においては、EICE配列と呼ばれる特定のDNA配列パターンとヒストンのアセチル化が重要であり、PU.1に結合しているp300がH3ヒストンをアセチル化するという、エピジェネティックな制御も関わっていることが明らかになりました。
PD-L2は過剰な免疫反応や炎症反応を抑制するための分子であることから、今回の研究でPD-L2遺伝子の発現に関わることが明らかになったこれらの転写因子を制御することができれば、免疫の抑制機能を効率よく調節する手法の開発につながると期待されます。
研究の背景
PD-1は活性化した免疫T細胞の表面に発現する受容体であり、そのリガンドとしてPD-L1とPD-L2が同定されています。炎症性刺激や細胞の活性化に伴い、それらの分子の発現が上昇し免疫活性を抑えます。そのため、PD-L1とPD-L2は過剰な免疫反応や炎症応答におけるチェックポイント分子として注目されています。がん細胞においてはPD-L1が恒常的に発現しているため、T細胞の増殖や機能が過剰に抑制されています。その結果、免疫システムはがん細胞を排除できなくなってしまいます。そのため、PD-1やPD-L1、PD-L2をターゲットとした薬剤の研究が注目されており、実際にPD-1およびPD-L1をターゲットとした治療薬の抗がん作用は示され、一部は既に臨床で用いられています。一方で、PD-L2が持つ生物学的な機能はまだよくわかっていませんが、獲得免疫における様々な事象にPD-L2が関わることが明らかになりつつあり、がんなどの治療薬のターゲット分子として注目を集めています。
PD-L1はリンパ球系の細胞だけでなく、他の様々な細胞でも発現する一方で、PD-L2は樹状細胞やマクロファージなどの一部の血球系に特異的に発現しますが、その発現制御機構はわかっていませんでした。そこで、本研究グループは、転写因子であるPU.1は樹状細胞やマクロファージの発生と、樹状細胞の機能に重要な遺伝子発現制御に重要であることからPU.1に着目し、PD-L2をコードするPdcd1lg2遺伝子の発現制御機構について調べました。
研究結果の詳細
転写因子であるPU.1は単体としても機能しますが、加えて、結合パートナーである転写因子IRF4あるいはIRF8とヘテロダイマーを形成し、直接遺伝子のプロモーターに結合することにより、遺伝子発現を制御していることもわかっています。そこで、骨髄由来樹状細胞(BMDC)において、PU.1、IRF4およびIRF8がPdcd1lg2遺伝子の発現制御に関わっているか調べました。siRNA(※2)を用いてPU.1、IRF4およびIRF8の遺伝子発現を抑制したところ、IRF4やPU.1のノックダウンではPD-L2の発現量は抑えられましたが、IRF8の場合は、発現抑制は認められませんでした。逆に、IRF4を過剰に発現させると、PD-L2の発現量は通常よりも増加しました。これらの実験結果から、PU.1とIRF4はPD-L2の発現制御に関わっていることがわかりました。
IRF4とPU.1のヘテロダイマーは、EICE配列と呼ばれる特定のDNA配列パターンに結合して遺伝子発現を開始させることがわかっています。Pdcd1lg2遺伝子のDNA配列を確認したところ、プロモーターやイントロン部位に複数のEICE配列が存在することが確認できました。そこで、ChIPアッセイと定量的PCRを組み合わせて、IRF4とPU.1がそれらの領域に結合するか検証しました。その結果、樹状細胞の染色体上では、Pdcd1lg2遺伝子の特定の領域(CNS3と命名)にPU.1とIRF4が有意に結合していることが確認されました。また、DNAとタンパク質の相互作用を直接的に検証するため、ゲルシフトアッセイ(EMSA:※3)を行った結果、IRF4とPU.1の複合体はCNS3中のEICE配列に強く結合しました。
次に、このPdcd1lg2遺伝子CNS3のEICE配列がIRF4とPU.1によって転写活性化されるかレポーターアッセイ法で検証しました。CNS3のEICE配列下流にルシフェラーゼ(発光タンパク質)の遺伝子を連結して培養細胞に導入し、IRF4とPU.1を共発現させたところ、発光タンパク質の強い発現が見られました。しかし、CNS3領域のEICE配列に変異を入れることによって配列を変えた場合においては、その発現は見られませんでした。このことから、IRF4とPU.1はCNS3領域のEICE配列依存的に遺伝子を転写活性化できることがわかりました。
データベースの情報から、PD-L2を発現する細胞(樹状細胞)では、他の血球系細胞と比べてCNS3を含む複数のCNS領域のH3ヒストンのリジン残基(K27)でアセチル化修飾が亢進していることがわかりました。本研究グループの過去の研究において、PU.1が樹状細胞においてCiita遺伝子(MHC class II発現を制御する共役因子)のアセチル化を調節することを突き止めています。さらに、PU.1はB細胞においてヒストンアセチルトランスフェラーゼ活性を有するp300と直接結合することもわかっていることから、CNS領域におけるヒストンのアセチル化にPU.1とp300が関わっているか調べました。ChIPアッセイとsiRNAを組み合わせた実験を行ったところ、PU.1やp300をノックダウンした場合、ほとんどのCNS領域においてH3ヒストンのアセチル化量が減少しました。このことは、CNSでのアセチル化にPU.1とp300関わっていることを示唆しています。
顆粒球単球コロニー刺激因子(GM-CSF)は、樹状細胞の分化を促したり、活性化を引き起こしたりする作用をもつ細胞外因子です。そこで、GM-CSF刺激が樹状細胞のPdcd1lg2遺伝子発現を上昇させ、そこにPU.1の動態変化が関わる可能性について検証しました。定量的PCRによるmRNA測定やフローサイトメトリー、ChIPアッセイを用いて解析した結果、ある種の樹状細胞ではGM-CSFによってPdcd1lg2遺伝子発現が著しく上昇し、この時、PD-L2遺伝子のCNS領域へ結合するPU.1量が増加すると共にCNS領域でのヒストンアセチル化が亢進することが判明しました。
以上の結果から、PU.1は、IRF4とヘテロダイマーを形成し、Pdcd1lg2遺伝子のEICE配列に直接結合して転写活性化する機能と、p300の染色体へのリクルートを促してヒストンH3のアセチル化に寄与する機能との、2通りの役割によってPD-L2発現を誘導することを解明しました。これらの検証の多くは主にBMDCを用いて行われましたが、同様の関係性が成立することはマウスの脾臓の樹状細胞でも確認されました。
PD-L2はがんだけでなく、アレルギーをはじめとした様々な免疫関連疾患にも関わっていることがわかっています。そのため、PD-L2はそれらの疾患の治療薬のターゲット分子の有力候補になり得ます。今後、より詳細にPD-L2遺伝子発現制御機構が解明され、それら転写因子を制御することができれば、免疫の抑制機能を効率よく調節する新たな手法の開発につながると期待されます。
※ 本研究は、日本学術振興会科研費基盤研究(B)、基盤研究(C)、東京理科大学学長特別研究推進費、東京理科大学特別研究助成金、文部科学省私立大学戦略的研究基盤形成支援事業、飯島藤十郎記念財団、武田科学財団の助成を受けて実施したものです。
用語
※1 クロマチン免疫沈降アッセイ:DNAに結合するタンパク質の結合部位を同定する技術。クロマチンのタンパク質とDNAの相互作用を検出できる。
※2 siRNA(small interfering RNA):21から23塩基対からなる低分子二本鎖RNA。二本鎖RNAと相補的な配列を持つmRNAが分解されるRNA干渉と呼ばれる現象に関与し、mRNAを破壊することによって特定の配列を持つ遺伝子の発現を抑制する。
※3 ゲルシフトアッセイ(EMSA):電気泳動を利用してDNA結合タンパク質を検出する実験手法。
論文情報
| 雑誌名 | : | The Journal of Immunology |
|---|---|---|
| 論文タイトル | : | Dual Roles of PU.1 in the Expression of PD-L2: Direct Transactivation with IRF4 and Indirect Epigenetic Regulation |
| 著者 | : | Keito Inaba, Takuya Yashiro, Ikumi Hiroki, Ryosuke Watanabe, Kazumi Kasakura and Chiharu Nishiyama |
| DOI | : | 10.4049/jimmunol.1901008 |
発表者
稲葉啓人 東京理科大学西山研究室(当時)<筆頭著者>
東京大学大学院 新領域創成科学研究科 メディカル情報生命専攻 修士課程2年(当時)
八代拓也 東京理科大学 基礎工学部 生物工学科 講師 <筆頭著者>
廣木郁美 東京理科大学大学院 基礎工学研究科 生物工学専攻 修士課程1年
渡辺良介 東京理科大学大学院 基礎工学研究科 生物工学専攻 2017年修了
笠倉和巳 東京理科大学 ポストドクトラル研究員(当時)
西山千春 東京理科大学 基礎工学部 生物工学科 教授 <責任著者>
西山研究室
西山教授のページ:https://www.tus.ac.jp/fac_grad/p/index.php?6821
研究室のページ:https://www.rs.tus.ac.jp/chinishi/
東京理科大学について
東京理科大学:https://www.tus.ac.jp/
ABOUT:https://www.tus.ac.jp/info/index.html#houjin
