ニュース&イベント NEWS & EVENTS
赤外線レーザーによるタンパク質の構造変化を金属錯体との複合化が促進することを発見
~病因タンパク質などを標的とした優れた構造破壊方法への応用を期待~
- ●代表的なタンパク質であるヒト血清アルブミンを亜鉛錯体と複合化させると、赤外線自由電子レーザーの照射に対して、アルブミンの折りたたみ構造の変化が促進される現象を見出しました。
- ●赤外線自由電子レーザーは、対象物質に応じて赤外線の強度や波長を変化させて用いることができ、材料、環境、生物、医学など幅広い分野での応用が検討されています。
- ●本研究で見出した現象は、病気の原因となるタンパク質を標的とした洗練された分解方法につながることが期待されます。
 |
東京理科大学理学部第二部化学科の秋津貴城教授、原口知之助教、理学部第一部化学科の築山光一教授、赤外線自由電子レーザー研究センターの川崎平康研究員、マドリード・コンプルテンセ大学のMauricio A. Palafox教授らの研究グループは、代表的なタンパク質の一種であるヒト血清アルブミンを、亜鉛を用いた金属錯体と複合化させて赤外線自由電子レーザーを照射すると、亜鉛錯体と複合化させない場合に比べてタンパク質分子の折りたたみ構造の変化が促進されるという現象を見出しました。
タンパク質はアミノ酸分子が「ペプチド結合」と呼ばれる結合で多数連なった、長い鎖状の大きな分子です。体内など環境中では、1本のタンパク質の分子鎖が部分的にらせん状(α-ヘリックス)やシート状(β-シート)に折りたたまれた構造(二次構造)をとっており、それが全体的な三次構造につながっています。その立体的な構造が、体内でのタンパク質の機能に活かされています。一般的なタンパク質は表面に親水性のアミノ酸構造を持つため水に溶け、一方、内側には疎水性の表面を持つ部位が存在し、脂溶性の分子など様々な分子を吸着することが知られています。
また、タンパク質を始めとした有機分子は炭素、水素、酸素、窒素などの原子が化学的に結合して形成されており、それぞれの化学結合においては原子がお互いの距離や角度を一定の周期でバネのように変化させる振動が起きています。赤外線は可視光よりも波長が長く(周波数が小さく)電波よりも波長が短い(周波数が大きい)電磁波ですが、そのなかでも中間領域の波長を持つ「中赤外線(中波長赤外線)」は、化学結合における振動のエネルギーとして吸収される特徴を持つため、分子の持つ化学結合の種類や状態を調べるために利用されています。
自由電子レーザーとは、自由電子のビームから電磁場により発生させた放射光を増幅させて取り出す、位相のそろった強力なレーザーのことです。赤外線領域の波長を持つように設定した装置が「赤外線自由電子レーザー(IR-FEL)」であり、強度や波長を対象物質に対応させて調整することができる利点があります。東京理科大学赤外線自由電子レーザー研究センターは、世界に十数ヶ所しかない自由電子レーザー施設のうちの一つであり、様々な研究活動に活発に利用されています。
本研究で見出された現象は、例えば病気の原因となるような異常な構造を持つタンパク質を標的として、適切に設計した金属錯体を結合させることで壊すなど、医学的な応用が期待されます。
研究の背景
秋津教授らは金属イオンと有機配位子からなる金属錯体の合成や構造・物性相関の研究に取り組んできました。これまで、タンパク質を金属錯体と複合化させることで、触媒効果や紫外線吸収効果など有用な機能を持つ人工的な金属複合タンパク質を創製することに成功してきました。また、東京理科大学赤外線自由電子レーザー研究センターの研究成果として、最近、タンパク質の多数の分子が凝集した構造を持つ、いわゆるアミロイドにIR-FELを照射すると、凝集が解消してバラバラになるという現象を見出しました。タンパク質の凝集体にはシート状の二次構造が多く存在することが知られています。タンパク質分子を形成している多数のペプチド(アミド)結合に吸収される波長に調整したIR-FELを照射することで、比較的強い力で折り重なっているシート状構造がそのエネルギーにより壊れ、結果として凝集していたタンパク質分子がバラバラになったと考えられています。これはアミロイドが蓄積することが原因の一つと考えられているアルツハイマー病などの治療への応用が期待されるところです。
一方、金属錯体と複合化させたタンパク質については、赤外線を照射させる効果についての研究はこれまでほとんど行われてきませんでした。赤外線は強度によっては皮膚のコラーゲンにダメージを与えるなど有害である場合があり、以前の紫外線吸収効果を持つものと同様に、赤外線吸収効果を持つ金属複合タンパク質が創製できれば大変有用という着想のもと、研究グループではすでに、タンパク質分子と同様にアミド結合の構造を持ち、すなわちタンパク質と同程度の波長を吸収する金属錯体(亜鉛と有機配位子で構成)をヒト血清アルブミンと複合化させ、IR-FELを照射する研究を実施し、昨年に第一報として報告しました(https://doi.org/10.3390/ijms20112846)。アルブミンの金属錯体との複合化は、計算科学を用いた理論的検討と実験的検討により成功を確認しましたが、IR-FELの照射結果としては当初の予想とは逆になり、金属錯体と複合化させたタンパク質のほうが、IR-FELによって二次構造が変化するという結果となりました。
研究結果の詳細
今回、この金属錯体と複合化させたタンパク質の赤外線照射に対する挙動をより一般化して検討するため、アミド結合をもたない金属錯体(ZnL)を新たに設計し、よりシンプルな、サレン錯体と呼ばれる構造の金属錯体を合成しました。
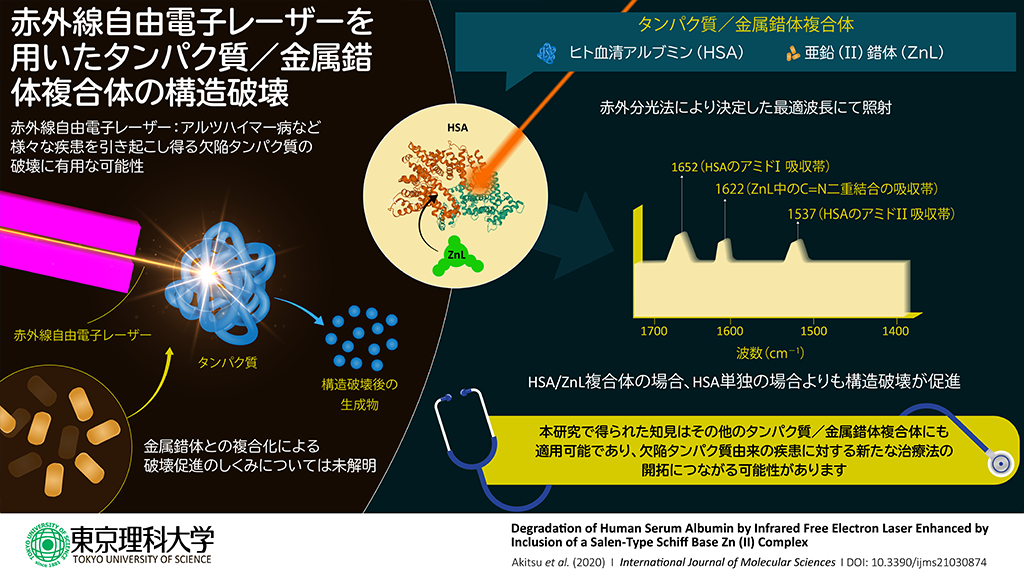
合成したZnLとヒト血清アルブミン(HSA)の複合化の確認については、調整した溶液について紫外可視(UV-vis)吸収スペクトル、円偏光二色性(CD)スペクトル、蛍光スペクトルの測定を行い、成功を確認しました。具体的には、UV-visスペクトルではZnL単独の場合に現れる電子遷移のスペクトルの一部が現れなくなったこと、CDスペクトルではHSA単独の場合のスペクトル形状に変化がありHSAの二次構造に(ZnLを吸着したため)変化があると考えられること、そして蛍光スペクトルでは蛍光共鳴エネルギー移動と呼ばれる、分子同士が結合しているなど非常に接近した場合でないと起こらない現象が起きたことから、ZnLとHSAの複合化を確認しました。
IR-FELの照射は、複合体の溶液から溶媒である水を蒸発させて複合体を固体にした膜を用意し、そこに照射を行いました。照射した赤外線の波長は、ZnL中に含まれる炭素―窒素二重(イミン)結合(C=N)が吸収する波長(波数 = 1622 cm−1)、アルブミン中のアミド結合の炭素―酸素二重結合(C=O)が吸収する波長(波数 = 1652 cm−1)、アルブミン中のアミド結合の窒素―水素単結合(N-H)が吸収する波長(波数 = 1537 cm−1)の3種類、採用しました。照射時間を0分、5分、10分、20分、30分の5通りとし、それぞれの照射後に赤外分光スペクトル測定を行い、アミド結合のC=O、N-Hそれぞれのスペクトルピークを波形分離することで、α-ヘリックス構造、β-シート構造の割合(%)を検討しました。結果として、波数1622 cm−1の赤外線照射は影響を与えませんでした。一方、アルブミン中のペプチド(アミド)結合にエネルギーを与える波数1652 cm−1、1537 cm−1のほうは、HSA単独の場合には二次構造の構成には概して変化はなかった一方、ZnLとの複合体のほうには赤外線照射時間に伴ってα-ヘリックス構造、β-シート構造の割合に変化が見られました。すなわち、ZnLとの複合化の結果、赤外線照射によるHSAの二次構造の変化が促進されたことが確認されました。
今回の研究成果の将来的な可能性について、秋津教授は「病気の原因となるタンパク質分子の洗練された分解方法へ応用できる可能性がある」と話しています。
※本研究は、公益財団法人スガウェザリング技術振興財団、および文部科学省光ビームプラットフォームの助成を受けて実施しました。
論文情報
| 雑誌名 | : | International Journal of Molecular Sciences |
|---|---|---|
| 論文タイトル | : | Degradation of Human Serum Albumin by Infrared Free Electron Laser Enhanced by Inclusion of a Salen-Type Schiff Base Zn (II) Complex |
| 著者 | : | Yuika Onami, Takayasu Kawasaki, Hiroki Aizawa, Tomoyuki Haraguchi, Takashiro Akitsu, Koichi Tsukiyama and Mauricio A. Palafox |
| DOI | : | 10.3390/ijms21030874 |
秋津研究室
研究室のページ:https://www.rs.kagu.tus.ac.jp/akitsu/index.htm
教授のページ:https://www.tus.ac.jp/fac_grad/p/index.php?5828
東京理科大学について
東京理科大学:https://www.tus.ac.jp/
ABOUT:https://www.tus.ac.jp/info/index.html#houjin
