ニュース&イベント NEWS & EVENTS
ヒトiPS細胞による若年性ネフロン癆の病態モデリング
-遺伝性腎臓病発症の仕組みの解明へ-
理化学研究所
東京理科大学
概要
理化学研究所(理研)バイオリソース研究センターiPS細胞高次特性解析開発チームの林洋平チームリーダー、荒井優大学院生リサーチ・アソシエイト(研究当時、東京理科大学大学院薬学研究科博士課程(研究当時))、東京理科大学薬学部生命創薬科学科の早田匡芳教授らの共同研究チームは、遺伝性腎臓病の一つである「若年性ネフロン癆(ろう)[1]」の患者から作られたiPS細胞(誘導性多能性幹細胞)[2]を利用して、その病態を培養皿上で再現することに成功しました。
本研究成果は、若年性ネフロン癆などの遺伝性腎臓病に関する発症機序の解明、新規治療法の開発に貢献すると期待できます。
若年性ネフロン癆は、NPHP1遺伝子[3]の変異によって起こり、腎臓に嚢胞(のうほう)(中に液体などを含む袋状の構造体)が多数形成されることで腎機能が低下し、やがて末期腎不全へと至る疾患です。しかし、その進行を止める根本的治療薬はなく、どのように腎嚢胞が形成されるのか、など不明な点が多く残されています。
今回、共同研究チームは、若年性ネフロン癆患者から樹立したiPS細胞で、一次繊毛[4]の形成・形態異常を見いだしました。また、患者iPS細胞から腎臓オルガノイド[5]を作製し、浮遊旋回培養することで、培養皿上で腎嚢胞の形成を再現しました。さらに、これらの異常が実際にNPHP1遺伝子の異常に起因することをゲノム編集技術[6]などを用いて検証しました。
本研究は、科学雑誌『Frontiers in Cell and Developmental Biology』オンライン版(6月26日付)に掲載されました。
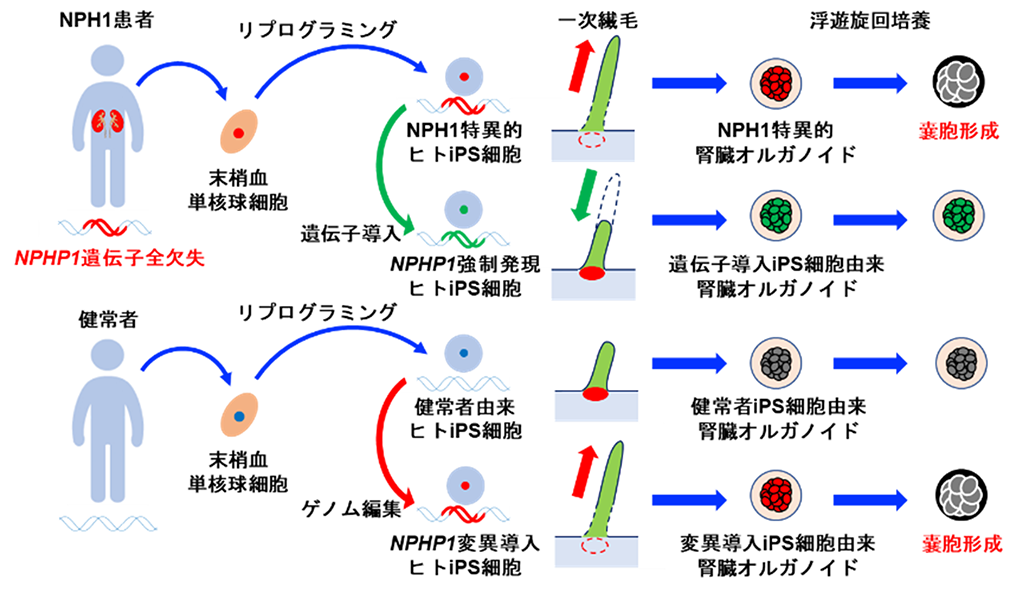
背景
若年性ネフロン癆(Nephronophthisis type 1:NPH1)は、一次繊毛の形成・機能に関連するNPHP1遺伝子の変異に起因する遺伝性の腎疾患です。腎臓で多数の嚢胞が形成・拡張し、腎臓全体の組織形態が崩壊していきます。そのため、腎臓の機能を担うネフロン[5]が障害され、大抵は10代のうちに腎不全を引き起こします。透析療法と腎移植以外に有効な治療法がないことから新規治療法の開発が望まれています。Nphp1遺伝子の異常を持つマウスモデルに関する研究が報告されてきましたが、詳しい発症機序は明らかになっていません。また、ヒト細胞を用いた有用な病態モデルはいまだ確立されていません。
林チームリーダーらの共同研究グループは、NPHP1遺伝子の全欠失を伴う若年性ネフロン癆患者の末梢血からiPS細胞を樹立したことを報告しました注1)。本研究では、これらのiPS細胞から腎臓オルガノイドを作製し、健常者由来iPS細胞や患者由来iPS細胞にNPHP1遺伝子を導入したものと比較解析することで、発症機序を解析するための病態モデルを作ることができるのではないかと考えました。さらに、健常者のiPS細胞から、ゲノム編集技術を使いNPHP1遺伝子の変異を持つiPS細胞を作製し、もとの細胞と比較解析することで、NPHP1遺伝子の異常自体が細胞または腎臓オルガノイドに与える影響を機能的に検証できるのではないかと予測しました。
研究手法と成果
本研究では、まずヒトNPHP1遺伝子を発現するプラスミドDNAベクター[7]を作製し、患者由来iPS細胞に導入しました。遺伝子導入iPS細胞を回収し、NPHP1遺伝子が作り出すネフロシスチン-1タンパク質の発現を評価したところ、患者由来iPS細胞ではその発現が完全に消失している一方、NPHP1遺伝子導入iPS細胞では発現が確認されました。ネフロシスチン-1タンパク質に免疫蛍光染色[8]を実施したところ、NPHP1遺伝子導入iPS細胞では培養条件下でもその発現が確認されました(図1)。
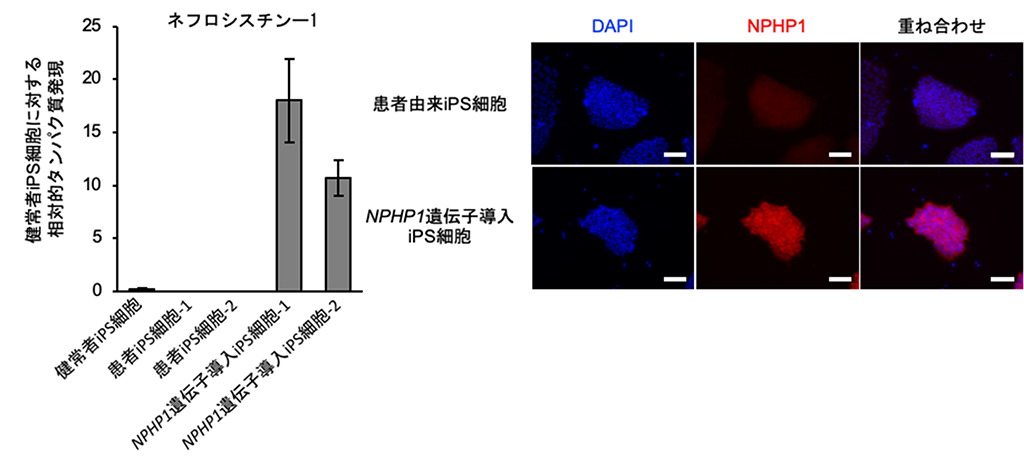
図1 患者由来iPS細胞からのNPHP1遺伝子強制発現
(左)健常者由来iPS細胞に対する、ネフロシスチン-1タンパク質の相対的な発現量を示すグラフ。
(右)ネフロシスチン-1タンパク質(NPHP1、赤)と細胞核(DAPI=蛍光色素の一種、青)を示す蛍光顕微鏡像。スケールバーは100マイクロメートル(μm、1μmは100万分の1メートル)。
また、ゲノム編集技術により、健常者由来iPS細胞からNPHP1遺伝子のフレームシフト変異[9]を伴うiPS細胞を作製しました(図2)。NPHP1遺伝子を標的としたCRISPR-Cas9[6]を用いたところ、標的部位において、塩基の欠失もしくは挿入が確認されました。ネフロシスチン-1タンパク質の発現を評価したところ、健常者由来でNPHP1遺伝子のフレームシフト変異導入iPS細胞において、その発現の消失が確認されました。
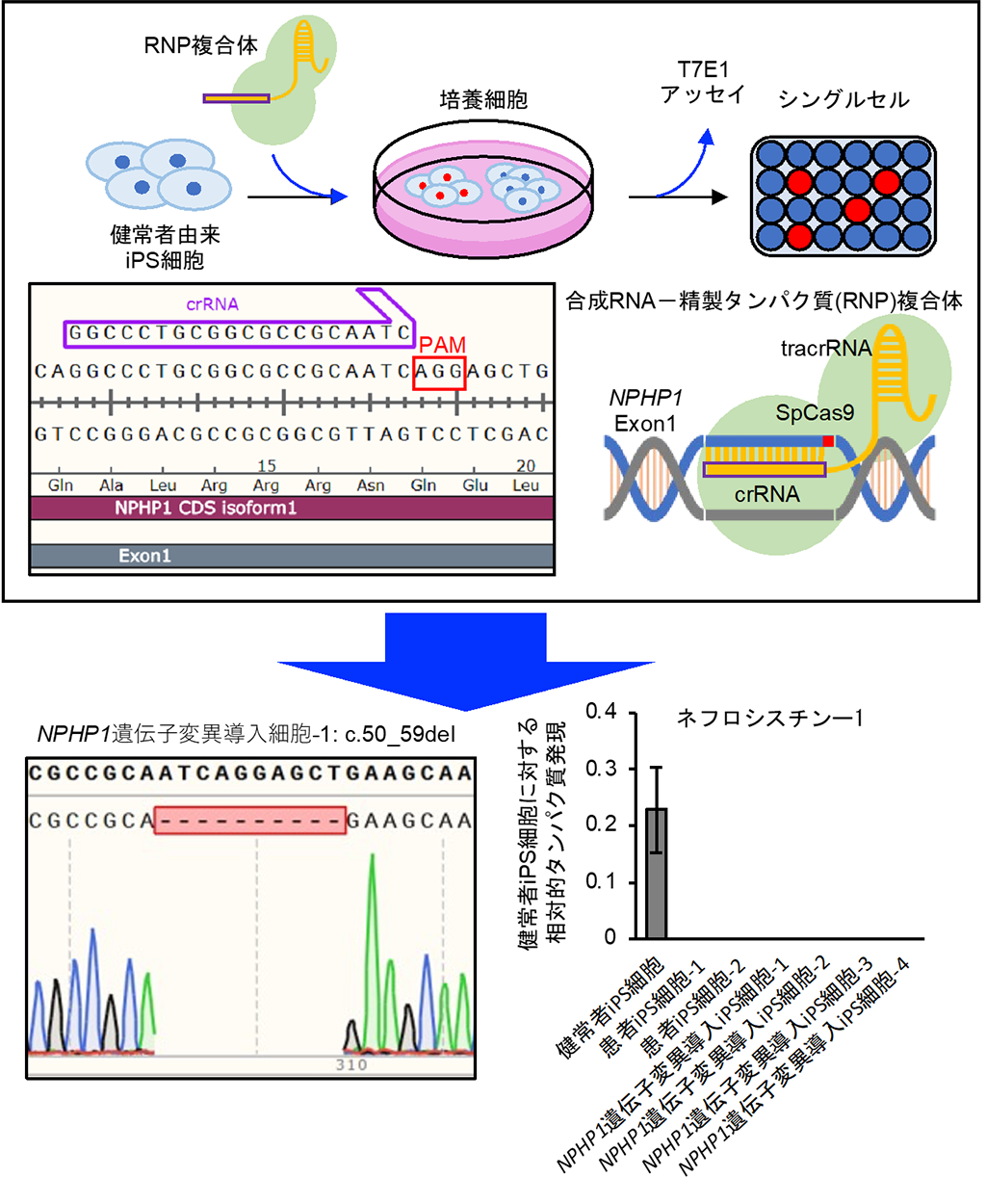
図2 健常者由来iPS細胞からのNPHP1遺伝子変異導入iPS細胞の作製
(上)CRISPR-Cas9を用いたゲノム編集手法を示す模式図。
(下左)遺伝子変異導入iPS細胞における、NPHP1遺伝子領域のゲノムDNAシーケンス解析結果。赤枠で囲われた領域はゲノム編集によって欠失した領域を示す。
(下右)健常者由来iPS細胞におけるネフロシスチン-1タンパク質の発現量を示す。
次に、これまでに樹立もしくは作製した各種iPS細胞を用いて、一次繊毛に着目した解析を実施しました。ネフロシスチン-1タンパク質は、一次繊毛の移行帯に局在することが知られています。そこで、一次繊毛とネフロシスチン-1タンパク質を免疫蛍光染色にて可視化し、一次繊毛の長さと一次繊毛を形成する細胞の割合について比較検討しました(図3)。まず、患者由来iPS細胞とNPHP1遺伝子導入(強制発現)iPS細胞を比較したところ、NPHP1遺伝子の強制発現によって、一次繊毛が短くなり、一次繊毛を形成する細胞の割合が増加しました(図3️下)。また、健常者由来iPS細胞とNPHP1遺伝子フレームシフト変異導入iPS細胞(以下、NPHP1遺伝子変異導入iPS細胞)を比較したところ、NPHP1遺伝子フレームシフト変異によって、一次繊毛が長くなり、一次繊毛を形成する細胞の割合が減少しました。
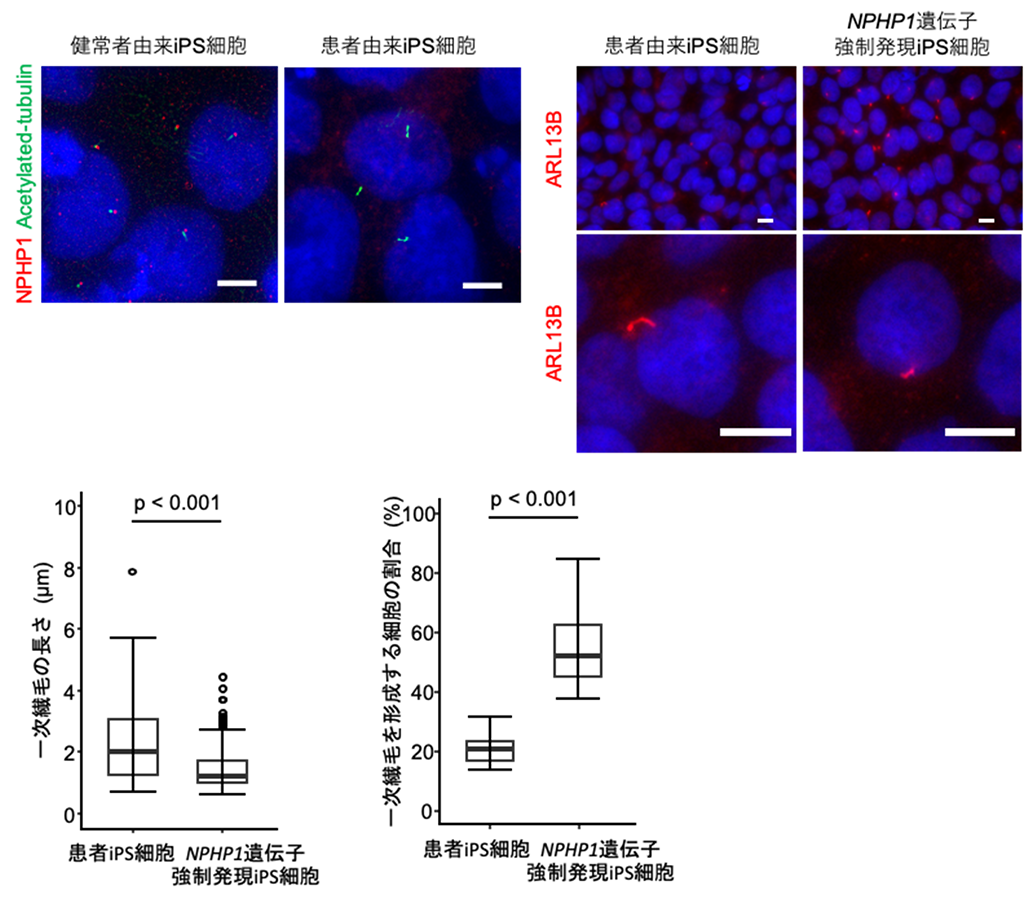
図3 ヒトiPS細胞における一次繊毛の形態に関する比較解析
(上左)健常者由来iPS細胞および患者由来iPS細胞における、一次繊毛マーカータンパク質Acetylated-tubulin(緑)、ネフロシスチン-1タンパク質(赤)に対する蛍光顕微鏡像。スケールバーは5μm。
(上右)患者由来iPS細胞およびNPHP1遺伝子強制発現iPS細胞における、一次繊毛マーカータンパク質ARL13Bに対する蛍光顕微鏡像。スケールバーは10μm。
(下)一次繊毛の長さおよび一次繊毛を形成する割合を測定解析した結果を示すグラフ。
さらに、各種iPS細胞から腎臓オルガノイドを作製し、比較検討を行いました。腎臓における原尿(血液をろ過した液体)の流れによるストレスを培養皿上で再現することを目的として、腎臓オルガノイドを常に旋回させながら(毎分90回転)、浮遊培養したところ、7日後、ネフロシスチン-1タンパク質が欠損しているiPS細胞(患者由来iPS細胞およびNPHP1遺伝子変異導入iPS細胞)から作製される腎臓オルガノイドにおいて嚢胞の形成が確認されました(図4)。
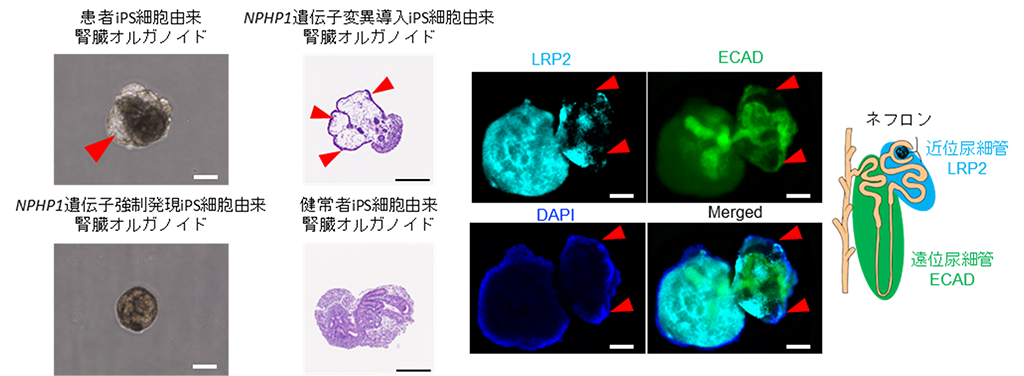
図4 浮遊旋回培養による疾患特異的な腎嚢胞形成
(左)7日間の浮遊旋回培養を行った腎臓オルガノイドの位相差顕微鏡像。赤矢印は嚢胞形成を示す。スケールバーは200μm。
(中)7日間の浮遊旋回培養を行った腎臓オルガノイドのヘマトキシリン・エオジン染色後の明視野顕微鏡像。赤矢印は嚢胞形成を示す。スケールバーは200μm。
(右)7日間の浮遊旋回培養を行った腎臓オルガノイドの近位尿細管(LRP2、水色)、遠位尿細管(ECAD、緑)に対する免疫蛍光染色後の蛍光顕微鏡像。DAPIは細胞核を示す。赤矢印は嚢胞形成を示す。「Merged」は他の「LRP2」「ECAD」「DAPI」蛍光顕微鏡像を重ね合わせたもの。スケールバーは100μm。
また、腎臓オルガノイドを用いてトランスクリプトーム解析[10]を実施したところ、ネフロシスチン-1タンパク質の欠損を伴う腎臓オルガノイドにおいて、(1)繊毛病[11]に関連する遺伝子の発現が全体的に低下、(2)一次繊毛関連遺伝子であるダイニン遺伝子(DNAH6、DNAH11、DNAH12)の発現が減少、(3)リボソームタンパク質に関連する遺伝子発現が全体的に低下、(4)コレステロール生合成および細胞周期関連遺伝子の発現が全体的に上昇することが示されました。つまりこれらのシグナル伝達経路や生物学的プロセスが腎嚢胞形成に関係している可能性を示唆しています。
今後の期待
本研究では、若年性ネフロン癆患者から樹立したiPS細胞で、一次繊毛の形成・形態異常と腎臓オルガノイド内での腎嚢胞の形成異常を再現できました。また、こうした異常が実際にNPHP1遺伝子の異常に起因することを、ゲノム編集技術などを使って検証しました。これらの研究成果は、ヒト細胞を用いて若年性ネフロン癆の病態モデルを開発した初めての例となります。
今後、この病態モデルを用いて、若年性ネフロン癆の分子病理機構の解明に迫っていくことができると考えられます。それとともに、この病態モデルを活用して、若年性ネフロン癆の新規治療法の開発に期待が持てます。若年性ネフロン癆は希少疾患です。しかし、この研究成果は、他のネフロン癆や他の遺伝性腎臓病、繊毛病など、その病態と症状が共通するところが多く、それらの疾患研究と治療法開発においても、今回の研究で培った技術と知見が活用されていくことが望まれます。
論文情報
タイトル
Patient-derived and gene-edited pluripotent stem cells lacking NPHP1 recapitulate juvenile nephronophthisis in abnormalities of primary cilia and renal cyst formation.
著者名
Yutaka Arai, Hidenori Ito, Tomoya Shimizu, Yuzuno Shimoda, Dan Song, Mami Matsuo-Takasaki, Tadayoshi Hayata and Yohei Hayashi
雑誌
Frontiers in Cell and Developmental Biology
DOI
補足説明
[1] 若年性ネフロン癆(ろう)
ネフロン癆は遺伝性の腎臓疾患で、腎髄質に嚢胞(のうほう)が形成され、進行すると腎線維化、末期には腎不全を引き起こす。その中でも若年性ネフロン癆は10代という若い年齢で発症する。透析療法と腎移植以外に有効な治療法がないことから、発症機序の解明と新しい治療法の開発が望まれてきた。
[2] iPS細胞(誘導性多能性幹細胞)
脊椎動物の初期胚が持つ、全ての種類の体細胞へ分化する能力を多能性という。多能性を持ち、試験管内で培養して無限に増やすことができる細胞を多能性幹細胞という。iPS細胞は、成人の皮膚細胞などの体細胞・組織から採取した細胞にOct3、Sox2、Klf4遺伝子などを導入し、初期化して多能性を持たせ、人工的に作製した誘導性多能性幹細胞のこと。
[3] NPHP1遺伝子
ヒト2番染色体上に位置し、ネフロシスチン-1タンパク質をコードする遺伝子。NPHP1遺伝子の欠失・変異は、若年性ネフロン癆の主要な遺伝的要因であることが知られている。このタンパク質は、細胞内で繊毛形成に関与していることが判明しているが、このタンパク質の機能不全がどのように若年性ネフロン癆の発症につながるかは不明な点が多い。
[4] 一次繊毛
細胞表面から外側に向けて突出して生えている1本の構造体の繊毛。一次繊毛はほぼ全ての哺乳動物細胞に存在する。一次繊毛には数多くの細胞膜受容体やチャネルが集積しており、一次繊毛はこれらの分子を介して光や化学物質、物理的な刺激など、細胞外からのさまざまなシグナルを受容するセンサーとして働き、細胞内へそのシグナルを伝達する。
[5] 腎臓オルガノイド、ネフロン
オルガノイドは培養細胞を用いて自己組織化しながら形成された組織構造。ネフロンは主に腎臓を構成する最小単位である。腎臓オルガノイドは「ネフロン」様の構造を含み、ヒト多能性幹細胞などから形成できる。腎臓オルガノイドは発生生物学研究、腎臓病などの疾患研究、腎毒性などの安全性薬理の研究など、さまざまなライフメディカル分野で利用が進みつつある。
[6] ゲノム編集技術、CRISPR-Cas9
生物が持つゲノムDNAの特定の塩基配列を狙って変化させる技術。従来、外来の遺伝子を細胞に導入して新しい形質を付け加える遺伝子組換え技術があったが、ゲノム編集技術は細胞が元々持っている性質を細胞内部で変化させることが特徴である。ゲノム編集に使用される、現在主流となっているツールとしてCRISPR-Cas9(clustered regularly interspaced short palindromic repeats-CRISPR associated protein 9:クリスパー・キャスナイン)が挙げられる。
[7] プラスミドDNAベクター
外来遺伝子を細胞内で発現させるために用いられる、大腸菌に由来するプラスミドDNAを改変して作成されたシステム。今回は特にヒトiPS細胞への遺伝子導入効率の高いPiggyBac Transposonシステムを用いて、NPHP1遺伝子の強制発現を行っている。
[8] 免疫蛍光染色
形態が維持された状態の細胞や組織サンプルにおいて、抗体を用いてタンパク質やその他の抗原を検出し、局在を確認するための手法。
[9] フレームシフト変異
塩基の欠失または挿入が起こることで、タンパク質を構成するアミノ酸残基に「翻訳」される三つ組みコドンの読み枠がずれるように生じる突然変異。これにより、この変異以降にコードするアミノ酸残基が変わり、終止コドンなどもずれてしまう。そのため、本来コードしているタンパク質とはかけ離れた性質のものが作られてしまう。その多くは機能しないので、細胞内で速やかに破壊されることになる。
[10] トランスクリプトーム解析
細胞で転写(発現)された全てのメッセンジャーRNA「トランスクリプトーム」を網羅的に解析する方法。この解析により、解析対象がどのような細胞種であるのか、遺伝子発現にどのような特徴があるのかなどを捉えられる。
[11] 繊毛病
一次繊毛など、細胞に生える繊毛の機能の異常に起因する病気を総称して「繊毛病」と呼ぶ。一次繊毛の異常から、ネフロン癆や嚢胞腎などの腎臓疾患の他にも、脳や眼などでの重篤な疾患など、多様な症状を引き起こすことが知られている。
共同研究チーム
理化学研究所 バイオリソース研究センター
iPS細胞高次特性解析開発チーム
- チームリーダー
- 林 洋平
- (ハヤシ・ヨウヘイ)
- (筑波大学 医学医療系 教授[連携大学院]、筑波大学 グローバル教育院
ライフイノベーション学位プログラム 教授[協働大学院]) - 大学院生リサーチ・アソシエイト兼研修生(研究当時)
- 荒井 優
- (アライ・ユタカ)
- (東京理科大学 大学院薬学研究科 博士課程(研究当時))
- 基礎科学特別研究員
- 伊藤 秀矩
- (イトウ・ヒデノリ)
- 研修生
- 清水 智哉
- (シミズ・トモヤ)
- (東京理科大学 大学院薬学研究科 博士課程、日本学術振興会特別研究員DC1)
- 研修生(研究当時)
- 下田 柚須乃
- (シモダ・ユズノ)
- (現 遺伝子材料開発室 研修生、
筑波大学 大学院ライフイノベーション学位プログラム 博士課程、
日本学術振興会特別研究員DC1) - 研修生(研究当時)
- 宋 丹
- (Dang Song)
- (筑波大学 大学院人間総合科学研究科 博士課程(研究当時))
- 開発研究員
- 髙﨑 真美
- (タカサキ・マミ)
東京理科大学 薬学部生命創薬科学科 分子薬理学分野
- 教授
- 早田 匡芳
- (ハヤタ・タダヨシ)
研究支援
本研究は、日本医療研究開発機構(AMED)再生・細胞医療・遺伝子治療プロジェクト「疾患特異的iPS細胞の樹立・特性解析・加工の高度化・効率化・情報公開(研究開発代表者:林洋平(23bm1423010h0001)」による助成を受けて行われました。また、本研究には理研バイオリソース研究センターから提供されたバイオリソース(ヒトiPS細胞株HPS0447、HPS0450、HPS1006)が使⽤されました。
