ニュース&イベント NEWS & EVENTS
がん細胞が細胞競合を利用して浸潤することを発見
~細胞競合の機能変容によるがん細胞の浸潤機構の解明~
研究の要旨とポイント
- 細胞競合とは、近接した同種細胞間で相対的に適応度の高い細胞が勝者細胞として生き残り、他方が敗者細胞として排除される現象で、がん細胞の排除に深く関わります。
- ヒトの大腸がんで好発するWntとRasシグナルの活性化が生じた上皮組織では、細胞競合の機能が変容し、組織内へびまん性に浸潤するがん細胞の産生が促進されることを明らかにしました。
- この結果は、遺伝子変異が蓄積したがん細胞は、細胞競合を利用して自己の浸潤能を増強することを見出した成果であり、この事象を標的とした新たながん治療法の開発に途を拓くことが期待されます。
研究の概要
東京理科大学生命医科学研究所がん生物学部門の昆俊亮准教授、同大学大学院生命科学研究科の中井一貴氏(博士過程3年)らの研究グループは、ヒトの大腸がんで好発するWntとRasシグナルが段階的に活性化した上皮組織では細胞競合の機能が変容し、間質内へびまん性に浸潤するがん細胞の産生が促進されることを明らかにしました。
細胞競合は偶発的に産生されたがん変異細胞を隣接する正常細胞が排除する抗腫瘍機能を担っていると考えられています。一般的に、正常な細胞が悪性化するために複数の遺伝子の変異が段階的に蓄積されますが、この過程において細胞競合の機能がどのように変化するかはよくわかっていませんでした。
ヒトの大腸がんは、APC遺伝子(*1)の機能が不全になりWntシグナル(*2)が活性化し、その後にRas(*3)シグナルが活性化することによりがんが進展することが知られています。そこで本研究では、APC→Rasの遺伝子変異の蓄積が細胞競合に及ぼす影響を検討し、Wntシグナルが活性化した上皮細胞では細胞競合の機能が変容し、本来は細胞競合によって管腔へと排除される活性化Ras変異細胞が組織内にびまん性に浸潤することを明らかにしました。
本研究は、遺伝子変異が蓄積したがん細胞は、細胞競合を利用して浸潤能を増強することを見出した成果であり、この事象を標的とした新たながん治療法の開発に途を拓くと期待されます。
本研究成果は2023年11月3日に国際学術誌Nature Communicationsにオンライン掲載されました。
研究の背景
細胞競合とは、性質の異なる上皮細胞が共在したとき、生体にとって相対的に適応度の高い細胞が勝者細胞として生き残り、他方が敗者細胞として排除される現象です。この細胞競合の生理的な役割の一つが、遺伝子変異によってがん変異化した細胞を周辺の正常上皮細胞が認識して排除することです。これまでに研究グループは、がん原遺伝子であるRasの活性化変異体を上皮細胞層の少数の細胞に発現させると、隣接する正常上皮細胞との細胞競合の結果、Ras変異細胞が敗者細胞として管腔側へ押し出されるように排除されることを報告してきました(Kon et al., Nat. Cell Biol., 2017; Akter et al., Cell Rep., 2022など)。このように、細胞競合は偶発的に産生されたがん変異細胞を排除する抗腫瘍機能を担っているため、広範な分野で注目されています。
一般的に、正常な細胞が発がんするためには複数の遺伝子の変異が段階的に蓄積されます(多段階発がん)が、この過程において細胞競合の機能がどのように変化するかはよくわかっていませんでした。ヒトの大腸がんは、APC遺伝子の機能が不全になりWntシグナルが活性化し、その後にRasシグナルが活性化することによりがんが進展することが知られています。そこで本研究では、APC→Rasの遺伝子変異の蓄積が細胞競合に及ぼす影響を検討し、実際の発がんプロセスにおける細胞競合の役割を調べました。
研究結果の詳細
まず、研究グループで以前に作出した細胞競合マウスモデル(タモキシフェンの投与量依存的に活性化Ras変異(RasV12)細胞の産生頻度を調整できるマウス)と全身でAPC遺伝子が欠損したマウスを掛け合わせることにより、Wntシグナルが活性化した上皮層でのRasV12細胞の排除率を腸管で検討しました。野生型マウスにRasV12細胞を単独に産生した場合では、細胞競合によってほとんどのRasV12細胞は管腔へと排除されましたが、APCが欠損した腸管にて出現したRasV12細胞は、基底膜へと逸脱、浸潤する細胞数が増加しました(図1)。
次に、APC/RasV12細胞の基底膜浸潤が細胞競合依存的に生じるかを検証するため、腸管オルガノイド(*4)を用いて実験を行いました。APC欠損マウス由来の腸管オルガノイドに低濃度タモキシフェンによってRasV12変異をモザイクに発現誘導すると、基底側へ逸脱する細胞が観察されたのに対し、高濃度タモキシフェンによってRasV12細胞を高頻度に産生させると、管腔もしくは基底側への逸脱率が顕著に低下しました。この結果より、APC/RasV12細胞は周辺がAPC欠損細胞に囲まれたとき細胞非自律的に、すなわち細胞競合によって基底側へと逸脱することが示されました。続いて、基底膜へと浸潤したAPC/RasV12細胞のその後の運命を追跡するため、タモキシフェン投与36日後の腸管を観察した結果、がん細胞は筋層深部まで浸潤しており、さらにリンパ管選択的に侵襲し、高頻度に腸管膜リンパ節へ転移しました。これらの結果より、APC欠損によりWntシグナルが活性化すると、細胞競合の機能変容が生じ、RasV12細胞は間質内へとびまん性に浸潤し、悪性度の高いがん細胞が産生されることが明らかとなりました。
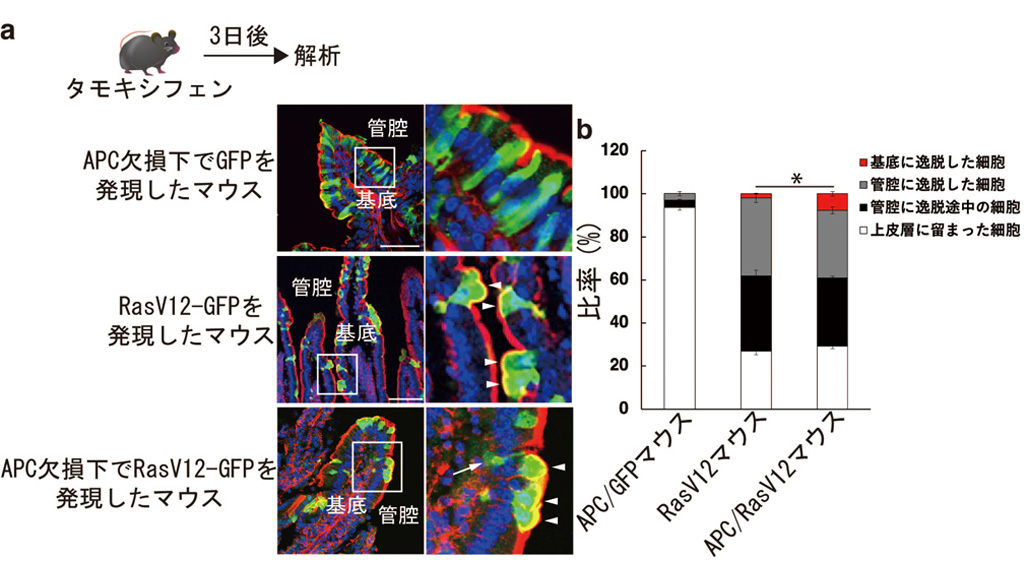
図1. RasV12変異誘導3日後のマウス腸管での変異細胞の挙動
(a)タモキシフェンによるRas変異誘導3日後のAPC欠損下でGFPを発現したマウス、RasV12-GFPを単独に発現したマウス、APC欠損下でRasV12-GFPを発現したマウスの腸管の様子を示す(左図)。矢頭は管腔側へ逸脱した細胞、矢印は基底膜へと浸潤した細胞を示す。青は核、赤はphalloidin、緑はRasV12を示す。(b)各マウスにおける管腔、もしくは基底に逸脱した細胞の比率を定量化した結果を示す。APC欠損下でRasV12-GFPを発現したマウスでは基底に逸脱する細胞数が有意に増加する(*<0.01)。スケールバー (50 μm)。
続いて、Wntシグナル活性化によるRasV12細胞のびまん性浸潤の分子論的メカニズムを解明するため、上記マウスで観察された現象を培養細胞の系にて再現しました。APC欠損と同様にWntシグナルを活性化するβ-cateninのN末端欠損変異体(β-catΔN)を恒常的に発現する細胞株(β-catΔN細胞)とこの変異体を発現し、かつテトラサイクリン依存的にRasV12を発現する細胞株(β-catΔN/RasV12細胞)を樹立しました。β-catΔN/RasV12細胞を単独で培養した場合では変異細胞は上皮層内に留まりましたが、β-catΔN細胞と混合培養すると(β-catΔN/RasV12細胞:β-catΔN細胞=1:50)、約半数ほどの変異細胞が基底側へと逸脱しました。このことから、マウスと同様に細胞競合依存的に変異細胞はびまん性に浸潤することがわかりました。
さらに、混合培養したβ-catΔN/RasV12細胞内の遺伝子発現の変化をトランスクリプトーム解析した結果、マトリックスメタロプロテアーゼ(MMP)(*5)の一つであるMMP21が著増することを突き止めました。実際に MMP21の発現を観察したところ、培養細胞、腸管オルガノイド、マウス腸管全ての実験系において細胞競合依存的にMMP21の発現が増加しました。さらに、MMP21ノックアウトマウスを導入したところ、APC/RasV12細胞の浸潤率が有意に低下したことから、MMP21がAPC/RasV12細胞のびまん性浸潤を制御する分子の一つであることの証左となりました。
MMP21の発現増加を司る因子を探索するため、上述したトランスクリプトームのデータを詳細に解析したところ、NF-κBシグナルが活性化することがわかりました。そこでNF-κBシグナルを阻害したところ、細胞競合依存的なMMP21の発現増加が抑制されました。さらには、NF-κB複合体のサブユニットの一つであるp65がMMP21のプロモーター領域に直接的に結合することを見出したことから、NF-κBシグナルの活性化がMMP21を直接的に発現増加すると結論づけました。
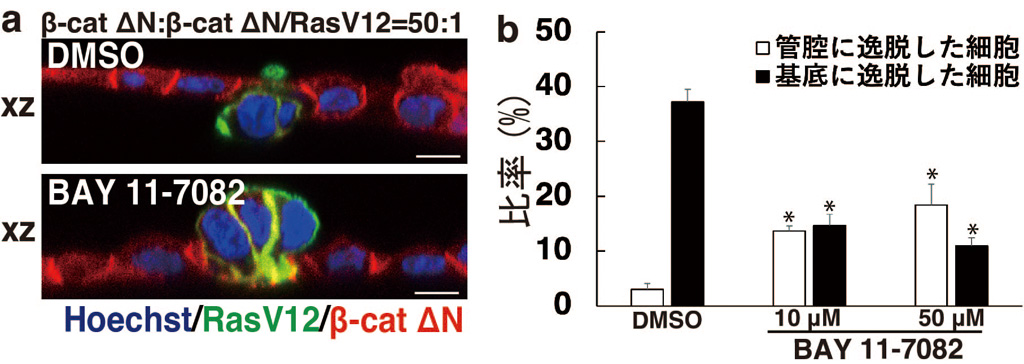
図2. NF-κBシグナルを阻害した際のβ-catΔN/RasV12細胞の挙動
(a)β-catΔN細胞とβ-catΔN/RasV12細胞を50:1の比率で共培養し、DMSOもしくはNF-κBシグナルの阻害剤であるBAY 11-7082を添加した細胞層のxz像を示す。青は核、緑はRasV12、赤はβ-catΔNを示す。スケールバー (10 μm)。 (b) DMSOまたは10、50 μMの BAY 11-7082を添加した際の管腔もしくは基底に逸脱した細胞の比率を定量化した結果を示す。BAY 11-7082はβ-catΔN/RasV12細胞の基底への逸脱率を低下させ、相対的に管腔への逸脱率を増加させる(*<0.05)。
興味深いことに、NF-κBシグナルを阻害すると、がん変異細胞の基底膜浸潤が抑制され、相対的に管腔側への逸脱率が増加したことから、NF-κBシグナルはがん変異細胞が逸脱する方向性を規定する中心的な因子であることが強く示唆されました(図2)。さらに解析を進めた結果、RIG-IやTLR3などの自然免疫系の分子がNF-κBシグナルを活性化することも明らかにしました(図3)。
最後に、初期大腸がんの臨床検体を用いて分子病理学的解析を行いました。その結果、正常部に比べて、腫瘍部にてMMP21、核内p65(NF-κBシグナルの指標)、核内β-catenin(Wntシグナルの指標)、リン酸化ERK(MAPKシグナルの指標)の発現が増加していました。さらに、MMP21の発現と核内p65、核内β-catenin、リン酸化ERKの発現が正に相関したことから、WntとMAPKシグナルが活性化したヒトの初期大腸がんではNF-κB-MMP21経路がその進展に重要な役割を担っていることが示唆されました。
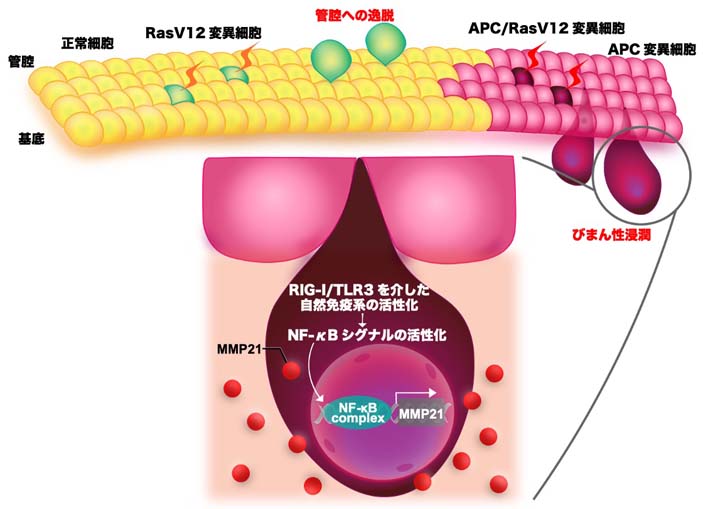
図3. 本研究成果の概念図
絨毛にてRasV12細胞が単独に産生した場合、細胞競合により変異細胞は管腔側に排除される。一方、APC遺伝子が変異した上皮層にRasV12細胞が出現すると、RIG-I/TLR3の自然免疫系を介したNF-κBシグナルの活性化によりMMP21の産生が促進され、変異細胞はびまん性に浸潤する。
今後の展望
本研究では、Wntシグナルが活性化した上皮層では、活性化Ras変異細胞は細胞競合を利用してびまん性に浸潤することを明らかにしました。がん細胞が有する浸潤能の抑止はがんを制することに大いに貢献するため、今後は細胞競合という視座に立った新しいがん治療戦略の確立が期待されます。
※本研究は、文部科学省科学研究費(20H03166, 21H00441)、AMED革新的がん医療実用化研究事業 (19217462)、高松宮妃癌研究基金、MSD生命科学財団、上原記念生命科学財団の助成を受けて実施したものです。
用語
*1 APC
Wntシグナル、平面内細胞極性形成、細胞分裂などを制御するがん抑制遺伝子。ヒト大腸がんの80%以上にAPC遺伝子の機能喪失変異が認められる。
*2 Wntシグナル
分泌性のWntが受容体に結合すると、古典的にはAPCを介したβ-cateninのリン酸化と分解が抑制され、TCF/LEF転写複合体により様々な分子の発現が誘導される。大腸がんをはじめとする種々のがんにおいてWntシグナルが活性化することが知られている。
*3 Ras
細胞の増殖、生存、分化、運動、接着を担う低分子量Gタンパク質。ヒトのがんで高頻度に活性化型変異が生じ、がん化を促進する。
*4 腸管オルガノイド
生体内での腸組織の空間的配置や生理機能を再現した3次元組織培養モデル。基礎研究から再生・移植医療などの応用研究に活用されている。
*5 MMP
マトリックスメタロプロテアーゼの略称。主に細胞外マトリックスを基質としたタンパク分解酵素であり、個体発生、生殖、組織の再構成に必要である。一般的に、がん細胞ではMMPsの発現が亢進しており、予後と相関することが知られている。
論文情報
雑誌名
Nature Communications
論文タイトル
Wnt activation disturbs cell competition and causes diffuse invasion of transformed cells through NF-κB-MMP21 pathway
著者
Kazuki Nakai, Hancheng Lin, Shotaro Yamano, Shinya Tanaka, Sho Kitamoto, Hitoshi Saitoh, Kenta Sakuma, Junpei Kurauchi, Eilma Akter, Masamitsu Konno, Kojiro Ishibashi, Ryo Kamata, Akihiro Ohashi, Jun Koseki, Hirotaka Takahashi, Hideshi Yokoyama, Yukihiro Shiraki, Atsushi Enomoto, Sohei Abe, Yoku Hayakawa, Tetsuo Ushiku, Michihiro Mutoh, Yasuyuki Fujita & Shunsuke Kon
