ニュース&イベント NEWS & EVENTS
新規抗がん剤の標的分子として期待されるCENP-Eの構造を解明
~より副作用の少ない抗がん剤の開発に向けて前進~
研究の要旨とポイント
- セントロメア関連タンパク質E(CENP-E)は、細胞分裂時の適切な染色体整列に関わるモーター分子であり、新規抗がん剤の標的分子として期待されています。
- X線結晶構造解析により、非加水分解性ATP類似体と結合した状態のCENP-Eモータードメインの構造を解明しました。
- 本研究成果は、CENP-Eを標的とした新規抗がん剤の開発に貢献すると期待されます。
東京理科大学薬学部生命創薬科学科の横山英志教授、薬学研究科薬科学専攻の渋谷明日香氏(2022年度博士課程修了)、静岡県立大学創薬探索センターの浅井章良教授、澤田潤一准教授、小郷尚久講師らの研究グループは、新規抗がん剤の標的分子として期待される、セントロメア関連タンパク質E(Centromere-associated protein E:CENP-E)の構造を、X線結晶構造解析により解明しました。これまで報告されたCENP-Eの構造は、ADPと結合した状態のみであり、ATP類似体と結合した状態の構造としては初めての報告となります。
がんは、遺伝子に異常を生じた細胞が、無秩序に細胞分裂を繰り返し増殖することにより、正常な細胞や組織を障害する疾患です。そのため、細胞分裂を阻害する薬剤は有効ながん治療薬となります。そのような作用機序をもつ抗がん剤として、微小管阻害剤があります。微小管は細胞分裂時の染色体の適切な移動・分配に関与します。そのため、微小管の機能を阻害すると、細胞分裂が停止し、がん細胞は死滅します。しかし、従来の微小管阻害剤は非分裂期の細胞においても微小管機能を阻害するため、末梢神経などに重篤な副作用が生じやすいという問題がありました。
そこで本研究では、CENP-Eとよばれる、動原体(*1)に局在するタンパク質に着目しました。CENP-Eは微小管に結合し、これに沿って移動するモータータンパク質(キネシン)です。CENP-Eは分裂期のみに作用するため、これを阻害しても非分裂期の細胞には影響を与えません。したがって、CENP-E阻害剤はより副作用の少ない抗がん剤となり得ます。
本研究では、CENP-E阻害剤の開発に向けて、まずはその構造を明らかにすべく、非加水分解性のATP類似体と結合した状態のCENP-Eの構造を、X線結晶構造解析により解明しました。そしてその構造を、ADPと結合した状態のCENP-Eや、他のキネシンと比較したところ、CENP-Eの特徴である「微小管に対するゆるやかな結合」には、ヘリックスα4が関与していることが示唆されました。本研究成果は、CENP-Eを標的とした新規抗がん剤の開発に貢献すると期待されます。
本研究成果は、2023年3月5日に国際学術誌「FEBS Letters」にオンライン掲載されました。
研究の背景
キネシンはモータータンパク質であり、ATPを加水分解しながら、その際に発生するエネルギーを利用して自身の構造を変化させることにより、微小管に沿って移動していきます。キネシンにはCENP-E以外にも多くの種類が存在し、細胞分裂や細胞内での物質輸送に重要なはたらきを担います。キネシンの動力部は、モータードメインと呼ばれる球状のドメインからなり、ATPを加水分解する領域(活性部位)と、微小管に結合する領域を含みます。
効果的な阻害剤の開発には、標的となる物質の構造とその生物学的活性の関係を把握する必要がありますが、CENP-Eと阻害剤の複合体構造はこれまで得られておらず、研究が進んでいませんでした。また、CENP-Eの構造は、これまでADPと結合した状態のものしか明らかになっていませんでした。そこで本研究では、非加水分解性ATP類似体との複合体構造の解明に取り組みました。
研究結果の詳細
ヒトCENP-Eモータードメインの遺伝子を大腸菌に組み込むことで、CENP-Eモータードメインタンパク質を大量に調製しました。これをカラムクロマトグラフィーにより精製し、ADP分解酵素(アピラーゼ)、およびATP類似体(アデニルイミド二リン酸(AMPPNP))を添加しました。その後、アピラーゼを除去し、溶液を濃縮して結晶化させました。これを用いて、X線結晶構造解析を行いました。
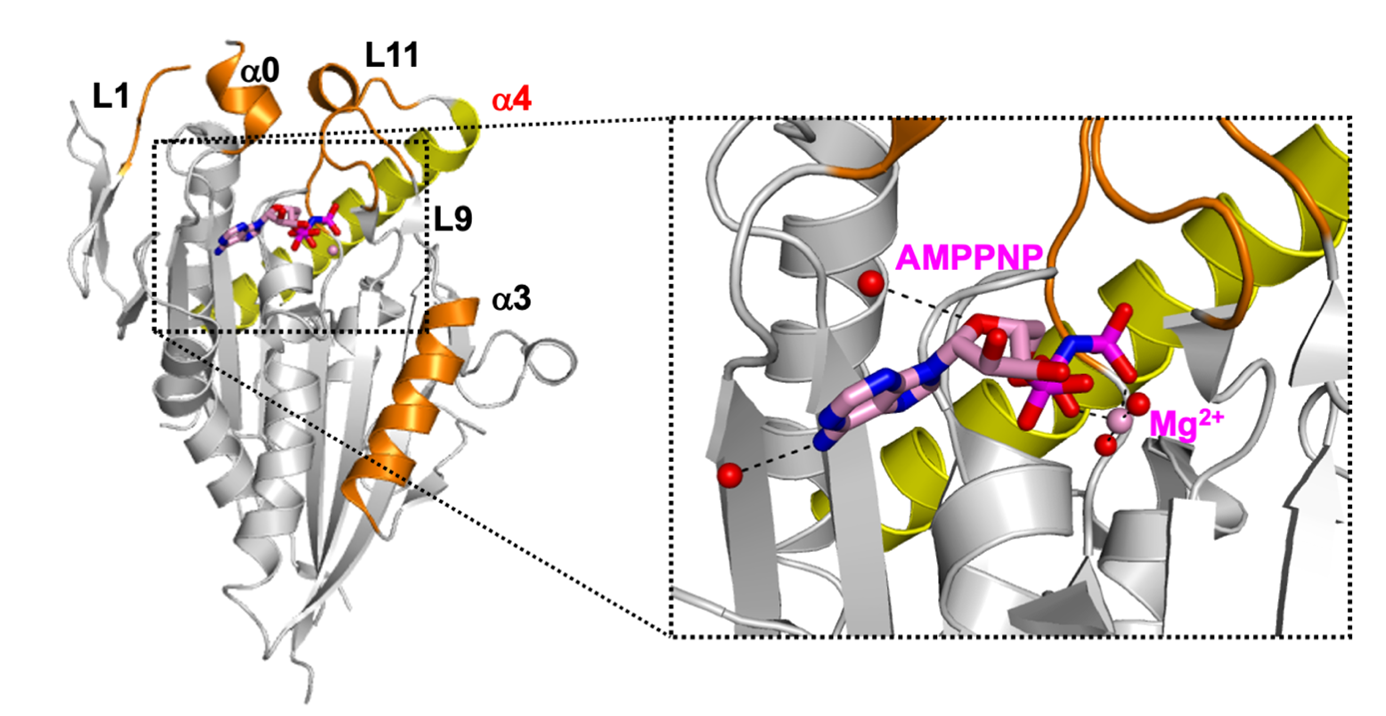
今回得られた結晶からは、既報のADP結合型よりも高い分解能(1.8Å)での構造決定に成功しました。結晶構造中のCENP-Eモータードメインは、8つの混合βシート、側面に位置し溶媒に露出するαヘリックス、およびN末端領域の小さな3つの逆並行βシートを有していました。また、ヌクレオチド結合部位では、1分子のAMPPNPが、1分子のMg2+イオンと4分子の水とともに収容されていました。
CENP-E-ADPとの構造比較
今回決定したAMPPNP結合型のCENP-Eの構造を、既報のADP結合型の構造と比較しました。すると、B因子の値から、AMPPNP結合型はADP結合型よりも安定である可能性が示唆されました。また、両者にはヌクレオチド結合部位にいくつかの構造上のちがいがみられました。さらに、AMPPNP 結合型には、ループL1とヘリックスα0が形成されていました。ヘリックスα0はADP結合型には見られない構造です。そして、AMPPNP 結合型では、ヘリックスα3およびループL9、L11の構造がADP結合型のものとは異なっていました。これらの領域は、ヌクレオチドの放出に関与すると報告されています。
他のキネシンとの構造比較
今回決定したAMPPNP結合型のCENP-Eの構造を、AMPPNPと結合した他のキネシンの構造と比較しました。すると、CENP-Eでは、ヘリックスα0およびループL1の領域が、他のキネシンよりも長くなっており、不安定となっている可能性が示唆されました。また、CENP-Eのヘリックスα3の傾きは、他のキネシンのものとは異なっていました。さらに、CENP-EのループL9は、他のキネシンと比べてAMPPNPに近接し、AMPPNPとより強く相互作用していました。
また、比較の結果から、CENP-Eがもつヘリックスα4の特徴が明らかになりました。ヘリックスα4は微小管との境界面に位置しており、この部位の構造変化はATP加水分解過程に連動して制御されています。キネシン-1との構造類似性から、CENP-Eでは他のキネシンに比べて、微小管への結合がATP加水分解過程全体を通して弱い可能性が示唆されました。これは、特にヘリックスα4のうち、微小管と接する側のアミノ酸残基の親水性が低下しているためです。なお、ADP結合型のヘリックスα4は、AMPPNP結合型よりも短くなっていることから、ADP結合型は、AMPPNP結合型よりもさらに微小管への結合が弱くなっている可能性が示唆されました。
本研究成果について、横山教授は「本研究の手法を用いてCENP-Eモータードメインとその阻害剤との複合体構造を解明できれば、複合体構造をもとにしたドラッグデザインが可能になり、副作用の少ない抗がん剤の開発に貢献できると期待されます」としています。
※ 本研究は、文部科学省の科学研究費助成事業(17K07316、22K06554)の助成を受けて実施したものです。
用語
*1 動原体
セントロメアDNAに形成される巨大なタンパク質複合体。染色体の分配に重要な働きを担う。
論文情報
雑誌名
FEBS Letters
論文タイトル
Crystal Structure of the motor domain of centromere-associated protein E in complex with a non-hydrolysable ATP analogue
著者
Asuka Shibuya, Akira Suzuki, Naohisa Ogo, Jun-ich Sawada, Akira Asai and Hideshi Yokoyama
