ニュース&イベント NEWS & EVENTS
がん免疫療法の治療効果予測の新たな指標候補を発見
~治療効果をさらに高める治療介入法や薬剤の開発にも期待~
研究の要旨とポイント
- 免疫チェックポイント阻害剤を用いた免疫療法は、新たながん治療法として注目されています。しかし、その有効性は20〜30%程度にとどまることから、有効性の予測指標が求められていました。
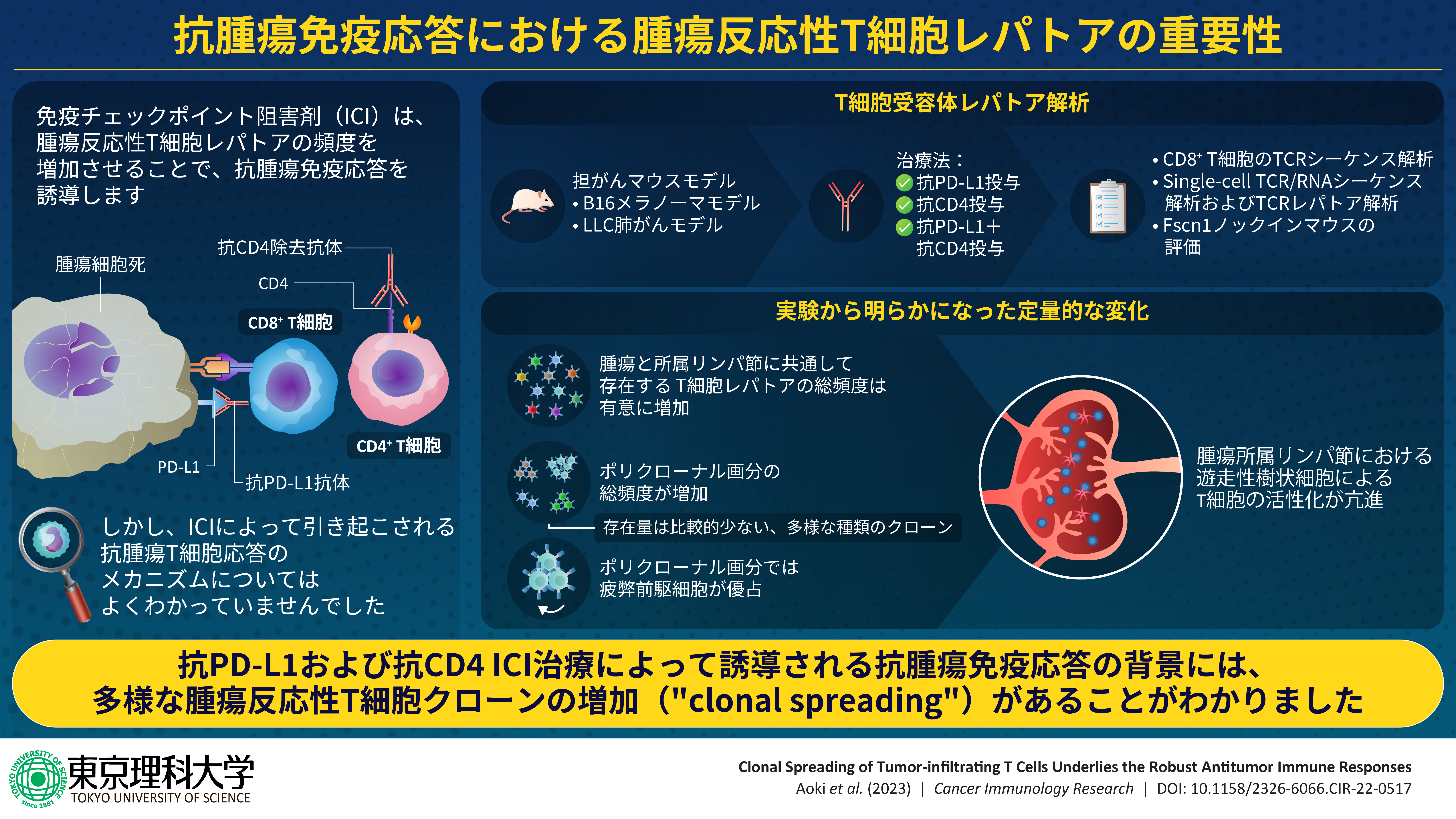
- 今回、免疫チェックポイント阻害剤(抗PD-L1抗体)および、同じく免疫抑制阻害作用のある抗CD4抗体を用いたがん治療においては、存在量としては比較的少ない、多様な種類の腫瘍反応性T細胞クローンの増殖が、抗腫瘍免疫応答に大きく寄与していることが明らかになりました。
- 本研究成果は、免疫チェックポイント阻害剤治療の有効性予測指標として応用でき、また、治療効果をさらに高める治療介入法や薬剤の開発にもつながると期待されます。
東京大学大学院医学系研究科の青木寛泰氏(博士課程4年)、同大学研究推進機構生命医科学研究所の上羽悟史准教授、七野成之助教、および松島綱治教授らの研究グループは、免疫チェックポイント阻害剤(抗PD-L1抗体)および、同じく免疫抑制阻害作用のある抗CD4抗体を用いたがん治療においては、存在量としては比較的少ない、多様な種類の腫瘍反応性T細胞クローンの増殖が、抗腫瘍免疫応答に大きく寄与していることを明らかにしました。
近年、「免疫チェックポイント阻害剤」を用いた免疫療法が、新たながん治療法として注目されています。免疫細胞の一つであるT細胞は、がん細胞を攻撃・排除する役割を担います。T細胞には、正常細胞に反応しないよう免疫抑制機構が備わっており、がん細胞の中には、この機構を利用してT細胞の攻撃から逃れるものがあります。免疫療法では、この免疫抑制機構を阻害することにより、がん細胞の排除を促します。この治療法には大きな期待が寄せられていますが、いまだ効果を得られるがん種が限られており、また対象となるがん種であっても有効性は20〜30%程度にとどまり、さらに費用も高額であることから、治療を開始する前に有効性を予測する指標が求められていました。
本研究では、この指標を開発するべく、腫瘍とその所属リンパ節(*1)について、T細胞レパトア(*2)を解析しました。すると、抗PD-L1抗体または抗CD4抗体投与によって、腫瘍と所属リンパ節に共通して存在するT細胞レパトアの総頻度が増加することがわかりました。また、このT細胞レパトアの総頻度増加は、腫瘍内で上位を占める一部のT細胞クローンの増殖ではなく、存在量としては比較的少ない、多様な種類のT細胞クローンの増殖によるものであることがわかりました。これらの結果は、抗PD-L1抗体および抗CD4抗体治療においては、多様な種類の腫瘍反応性T細胞クローンの増殖が、抗腫瘍免疫応答に大きく寄与していることを示唆しています。
本研究成果は、免疫チェックポイント阻害剤の有効性予測指標として応用でき、また、免疫チェックポイント阻害剤と併用することで、その治療効果をさらに高める治療介入法や薬剤の開発にもつながると期待されます。
本研究成果は、2023年3月29日に国際学術誌「Cancer Immunology Research」にオンライン掲載されました。
研究の背景
T細胞は、胸腺における発生の過程で抗原受容体(TCR;T-cell receptor)遺伝子が再構成されることにより、最大1億種類もの多様なT細胞レパトアが作り出されます。このとき、遺伝子はランダムに選択されるため、自己成分に反応するT細胞も生じますが、そのようなものは胸腺でそのほとんどが除去されます(中枢性免疫寛容)。一部残ったものについては、制御性T細胞によってその免疫応答が抑制されます(末梢性免疫寛容)。がん細胞が免疫逃避のために利用するのは、この末梢性免疫寛容の仕組みです。本研究で用いた抗CD4抗体は、制御性T細胞を一時的に除去する効果を有し、これにより、T細胞によるがん細胞の排除が促されます。
腫瘍は複数種の抗原を発現しており、また、各抗原に対して複数種のT細胞クローンが反応することから、T細胞による抗腫瘍免疫応答を評価するためには、T細胞クローンの集合であるT細胞レパトアを調べる必要があります。これまでの研究では、特定のT細胞クローンに対する頻度の偏りが主に評価されてきましたが、T細胞レパトアを評価する上では、T細胞クローンの多様性も重要な指標となります。そこで、本研究ではT細胞クローンの多様性に注目しました。
研究結果の詳細
右脇腹に腫瘍を有する担がんモデルマウスに、抗PD-L1抗体と抗CD4抗体のいずれか、もしくはその両方を投与しました(抗PD-L1投与群、抗CD4投与群、抗PD-L1+抗CD4投与群)。その後、腫瘍および所属リンパ節(右上腕リンパ節)からCD8+T細胞を回収し、TCR-sequencing解析を用いてT細胞レパトアを解析しました。
以前の研究から、抗CD4抗体投与によって、腫瘍と所属リンパ節に共通して存在するCD8+T細胞レパトア(重複レパトア)は、その総頻度が増加することがわかっていました。しかし、抗PD-L1抗体については不明でした。そこで、抗PD-L1投与群および抗PD-L1+抗CD4投与群について、重複レパトアを調べました。すると、どちらの場合にも、重複レパトア総頻度の増加が見られました。
次に、この同定された重複レパトアを、腫瘍内での頻度に基づき、高頻度(上位10位以内)の「オリゴクローナル画分」と、中〜低頻度(11位以下)の「ポリクローナル画分」に分類しました。すると、3つすべての投与群について、オリゴクローナル画分の総頻度はあまり変化せず、ポリクローナル画分の総頻度が有意に増加しました。これにより、抗PD-L1抗体または抗CD4抗体投与によって見られた重複レパトアの総頻度の増加は、ポリクローナル画分、すなわち中〜低頻度のT細胞クローンの増殖によるものであることがわかりました。これは、上位クローンのさらなる増殖("Clonal skewing")ではなく、多様なクローンの穏やかな増殖("Clonal spreading")が重要であることを示します。
さらに、このポリクローナル画分に含まれるT細胞の性質を調べるために、single-cell TCR/RNA sequencing解析を用いて、T細胞の状態を調べました。すると、ポリクローナル画分には、オリゴクローナル画分よりも「疲弊前駆T細胞」が多く含まれることがわかりました。免疫チェックポイント阻害治療において持続的な抗腫瘍免疫応答には、疲弊前駆T細胞が重要であることが知られています。
加えて、新たに作成した遺伝子改変マウスを用い、遊走性樹状細胞(腫瘍反応性T細胞の活性化を担う細胞)を選択的に除去しました。すると、腫瘍内の重複レパトアの総頻度が低下しました(抗PD-L1投与群、抗PD-L1+抗CD4投与群)。このとき、オリゴクローナル画分の総頻度は変化しない一方で、ポリクローナル画分の総頻度は低下していました。これにより、遊走型樹状細胞によるT細胞の活性化が、抗PD-L1抗体または抗CD4抗体治療における"Clonal spreading"に大きく寄与していることがわかりました。
これらの結果は、腫瘍反応性T細胞の"Clonal spreading"が、抗PD-L1抗体および抗CD4抗体によって誘導される抗腫瘍免疫応答に大きく寄与することを示唆します。
本研究成果について、上羽准教授は、「本研究成果を、免疫チェックポイント阻害剤の有効性予測・診断法として応用することで、高額医療である免疫チェックポイント阻害剤を、より有効性が期待できる患者に届けることが可能となります。また、長期的には、本研究で見出した"Clonal spreading"という応答を指標として、免疫チェックポイント阻害剤と併用した際により強い抗腫瘍免疫応答を誘導する、治療介入法や薬剤などの開発にもつながると期待されます」と今後の応用に期待を示しています。
※ 本研究は、日本学術振興会(20281832、17929397)、および日本医療研究開発機構(AMED)(JP21gm6210025、22fk0310509s0101、22ama221306h0001)の助成を受けて実施したものです。
用語
*1 所属リンパ節: 原発巣である腫瘍部位からリンパ管で直接繋がったリンパ節。所属リンパ節でT細胞が増殖し、血液循環を介して腫瘍へ輸送される。
*2 T細胞レパトア: 同一の受容体をもつT細胞の集団は「T細胞クローン」と呼ばれ、さまざまな受容体をもつT細胞クローンのコレクションが「T細胞レパトア」と呼ばれる。
論文情報
雑誌名
Cancer Immunology Research
論文タイトル
Clonal spreading of tumor-infiltrating T cells underlies the robust antitumor immune responses
著者
Hiroyasu Aoki, Mikiya Tsunoda, Haru Ogiwara, Haruka Shimizu, Haruka Abe, Tatsuro Ogawa, Takaya Abe, Shigeyuki Shichino, Kouji Matsushima, Satoshi Ueha
