ニュース&イベント NEWS & EVENTS
ATP合成酵素の一部分である回転分子モーター「F₁-ATPase」の回転機構を解明
~生物がもつ世界最小の回転分子モーターのエネルギー変換の仕組みを理解する~
東京理科大学
学習院大学
研究の要旨とポイント
- F型ATP(アデノシン5´-三リン酸)合成酵素に含まれる、回転する生物分子モーター「F1-ATPase(*1)」は、ATPを加水分解する際のエネルギーで駆動され、反時計方向に回転します。しかし、ATPの加水分解反応と回転角度の関係は、長年理解が曖昧なままでした。
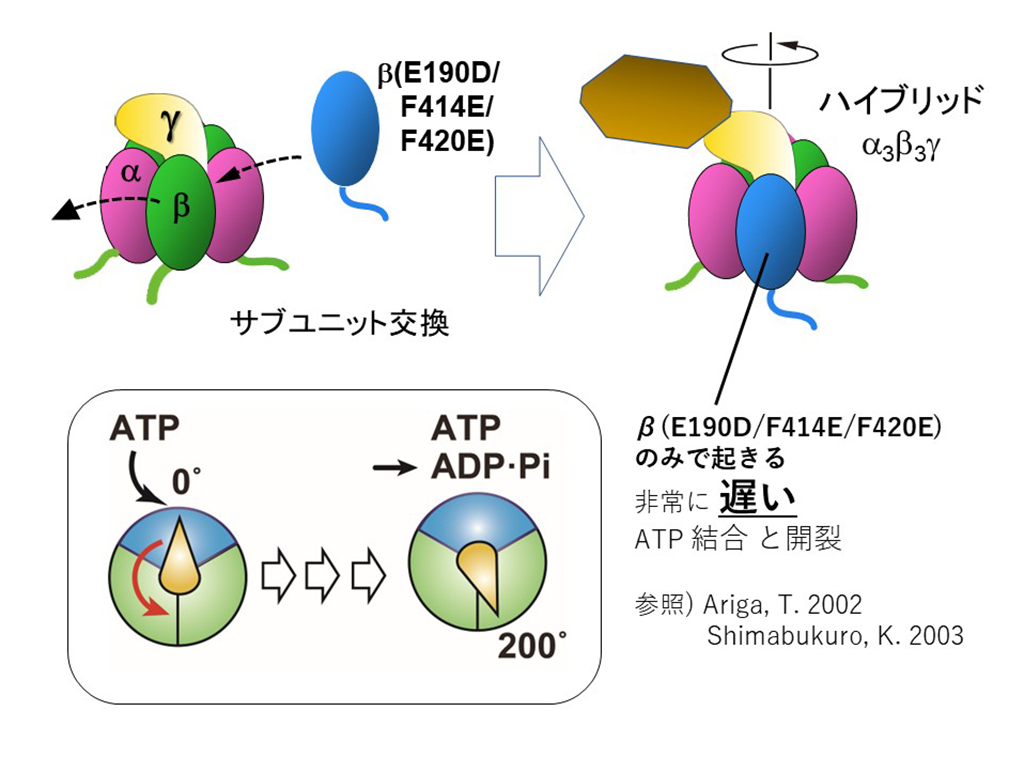
- F1-ATPaseのもつ3つの触媒部位のうち1つを、ATPとの反応が極端に遅い変異型に置換することで、ATP結合からATPの開裂までの回転角度が200ºであることを明らかにしました。
- 結核菌ATP合成酵素は近年薬剤ターゲットとしても着目されており、回転駆動の仕組みを知ることは、結核の治療薬開発にもつながると期待されます。
- 回転時の化学・力学的エネルギー変換効率はほぼ100%であることが知られています。F1-ATPaseの回転機構の解明は、生物のもつ高効率エネルギー変換の仕組みの理解につながる重要な知見であり、マイクロマシンなどの設計の際にも役立つ可能性があると期待されます。
東京理科大学理工学部応用生物科学科の政池知子准教授、学習院大学理学部物理学科の西坂崇之教授、橋本優氏(現所属・浜松ホトニクス株式会社、研究時の所属・学習院大学)らの研究グループは、F型ATP合成酵素に含まれる回転分子モーター「F1-ATPase」の回転機構の解明を目指し、F1-ATPaseのもつ3つの触媒部位のうちの1つを、ATPとの反応が極端に遅い変異型に置換することで、ATPを結合してからこれを分解するまでの間に、F1-ATPaseの中心軸が200º回転することを明らかにしました。
F型ATP合成酵素は、生体内でエネルギー通貨として用いられるATPを合成する酵素で、ほとんどすべての生物が共通して利用している重要な蛋白質です。この酵素の大きな特徴として、タンパク質分子が回転することが挙げられます。F1-ATPaseはその回転分子モーターであり、回転方向に依存した可逆的な触媒活性を示すことが知られています。通常、F1-ATPaseはATPを加水分解した際のエネルギーで駆動され、反時計回りに回転しますが、強制的に時計回りに回転させることでADP(アデノシン二リン酸)とリン酸からATPを合成します。
本研究では、このような特異な性質をもつF1-ATPaseの回転機構を明らかにするべく、ATPの加水分解による反時計回りの回転について研究を行いました。F1-ATPaseのもつ3つの触媒部位のうちの1つを、ATPとの反応(結合および分解)が極端に遅い変異型に置換した、ハイブリッド型酵素を作製し、光学顕微鏡を用いて1分子レベルでその回転を観察することで、ATPを結合してからこれを酵素上で加水分解する(ATPが開裂する)までの間に、F1-ATPaseの中心軸が200º回転することを明らかにしました。この生物のもつ世界最小の回転分子モーターの回転機構を解明し、生物のもつ高効率のエネルギー変換の仕組みを理解することで、薬剤開発やナノテクノロジーに応用できると期待されます。
本研究成果は、2022年12月21日に国際学術誌「Biophysical Journal」にオンライン掲載され、印刷体は2023年2月7日に122巻3号に掲載されました。
研究の背景
F1-ATPaseは主に3種類のタンパク質サブユニットから構成され、αサブユニットとβサブユニットがそれぞれ3つずつ交互に並んだリングに、1つのγサブユニットが突き刺さる構造をしています。このγサブユニットが、モーターの中心軸として一方向に回転します。なお、ATPとの結合部位(触媒部位)は、それぞれ3つのβサブユニット中に存在しています。
これまでの研究から、回転の際にF1-ATPaseは、80ºとそれに続く40ºの回転ステップから構成された「ステップ状回転」を示し、いくつかの停止期を挟んで回転することがわかっていました。F1-ATPaseによるATP加水分解反応は、(1)ATPの結合、(2)高エネルギーリン酸結合の加水分解(酵素上でのATP開裂の過程)、(3)生成物(ADPとリン酸)の解離、という3つの反応素過程に分けられるため、回転の停止期はそれぞれ素過程に対応したものと推定されてきました。
特に、ATP結合前の停止(ATP結合待ちの停止)時の角度を0ºとしたとき、高エネルギーリン酸結合の加水分解が何度(º)で起こるかについては、蓄積されたこれまでの研究結果から200ºであるとの推定がなされてきました。しかし、確証はまだ得られておらず、長年未解明のままでした。そこで、本研究グループは、各反応素過程と各回転ステップの相関を明らかにするべく研究を行いました。
研究結果の詳細
本研究では、好熱菌(Bacillus PS3)のF1-ATPaseを用いました。従来の実験では、野生型に比して各停止期の時間が長い、βサブユニットのE190D変異体が用いられてきましたが、E190D変異体の0ºにおける停止(ATP結合待ちの停止)には、温度依存的なものが含まれることがわかり、実験結果の解釈を複雑にしていました。そこで本研究では、その問題点を解消するべく、ATPとの結合速度が極端に遅いF414E/F420E(以降「FEFE」と表記)変異を、E190D変異体にさらに導入しました。これにより、「ATP結合待ちの停止」と「酵素上でのATP開裂待ちの停止」の時間がどちらも長くなった変異型βサブユニットを作製しました。
野生型F1-ATPaseの3つのβサブユニットのうち、1つをこの変異型βサブユニットで置換したハイブリッド型酵素「1×β(E190D/FEFE)」、2つを置換したハイブリッド型酵素「2×β(E190D/FEFE)」、そして3つとも置換したノンハイブリッド型酵素「3×β(E190D/FEFE)」を作製しました。これら各変異型酵素をガラス面に固定し、さらに中心軸であるγサブユニットに金属ビーズを取り付けることで、各反応素過程を待つ間の回転停止を、光学顕微鏡を用いて観察しました。
すると、まず3×β(E190D/FEFE)では、1回転あたり6回の停止(0º、80º、120º、200º、240º、320º)が観察されました。これらの停止は、80ºと40ºの回転が交互に繰り返されてできたものであり、3組の短い停止と長い停止に分けられました。40º回転の前に見られる長い停止は、元々のE190D変異体の回転パターンに類似しており、また、100µMまではATP濃度に依存せずほぼ一定の長さを示したことから、「酵素上でのATP開裂待ちの停止」と考えられました。また、80º回転の前に見られる短い停止は、ATP濃度に明らかに依存していたことから、「ATP結合待ちの停止」と考えられました。
次に、2×β(E190D/FEFE)では、4回(0º、120º、200º、320º)の停止が見られました。これは、それぞれの変異型βサブユニットが200º離れた停止期をもち、それぞれが120ºずれて配置されていることに一致しました。長い停止と短い停止の傾向は、3×β(E190D/FEFE)と類似しており、短い停止の長さはATP濃度に依存していました。
最後に、1×β(E190D/FEFE)では、2回(0º、200º)の停止が見られました。解析したところ、0ºにおける停止は、ATP濃度が100µM、1mMのとき、それぞれ2.0±0.1秒、0.64±0.03秒となり、ATP濃度が増加するほど停止時間が短くなる濃度依存性を示しました。一方、200ºにおける停止では、ATP濃度が100µM、1mMのとき、それぞれ4.0±0.0秒、3.7±0.1秒とそれほど変化がありませんでした。これにより、0ºにおける停止は「ATP結合待ちの停止」であり、200ºにおける停止が「酵素上でのATP開裂待ちの停止」であることがわかりました。すなわち、ATPを結合してから200º反時計回りに回転したとき、ATPの開裂が起こることが、これにより明確に示されました。
結核菌ATP合成酵素は近年結核の薬剤ターゲットとしても着目されており、回転駆動の仕組みを知ることは、薬剤の開発にもつながると期待されます。また、この分子の高効率のエネルギー変換の仕組みを理解すれば、マイクロマシンや分子ロボットの開発などナノテクノロジーに応用できる可能性があります。
※本研究は、日本学術振興会の科学研究費助成事業・新学術領域研究(JP16H00808、JP26103527、JP87003306)、研究活動スタート支援(JP22870028)、科学技術振興機構の戦略的創造研究推進事業(さきがけ)(JPMJPR12L8)の助成を受けて実施したものです。
用語
*1 ATPase
ATPのもつ3つのリン酸基から1つを加水分解により切り出し、ADPとリン酸を生じさせる酵素群のこと。リン酸基間に形成された高エネルギーリン酸結合の加水分解により、生体内での反応をすすめるために必要なエネルギーがこれにより供給される。
論文情報
雑誌名
Biophysical Journal
論文タイトル
Direct identification of the rotary angle of ATP cleavage in F1-ATPase from Bacillus PS3
著者
Yuh Hasimoto, Mitsuhiro Sugawa, Yoshihiro Nishiguchi, Fumihiro Aeba, Ayari Tagawa, Kenta Suga, Nobukiyo Tanaka, Hiroshi Ueno, Hiroki Yamashita, Ryuichi Yokota, Tomoko Masaike, Takayuki Nishizaka
DOI
発表者
橋本優 浜松ホトニクス株式会社 中央研究所 筑波研究センター
(研究時の所属・学習院大学)<筆頭著者・責任著者>
須河光弘 研究時の所属・学習院大学 理学部 物理学科
西口能広 研究時の所属・学習院大学 理学部 物理学科
饗庭史浩 東京理科大学大学院 理工学研究科 応用生物科学専攻 修士課程2年
田川絢理 東京理科大学大学院 理工学研究科 応用生物科学専攻 修士課程1年
菅健太 東京理科大学大学院 理工学部 応用生物科学科 4年
田中信清 東京理科大学 理工学部 応用生物科学科 助教
上野博史 東京大学大学院 工学系研究科 応用化学専攻 講師
山下大貴 東京理科大学大学院 理工学研究科 応用生物科学専攻 修士課程2年
横田龍一 研究時の所属・東京理科大学大学院 理工学研究科 応用生物科学専攻
政池知子 東京理科大学 理工学部 応用生物科学科 准教授 <責任著者>
西坂崇之 学習院大学 理学部 物理学科 教授 <責任著者>
お問い合わせ先
【研究に関する問い合わせ先】
東京理科大学 理工学部 応用生物科学科 准教授
政池 知子(まさいけ ともこ)
E-mail:tmasaike【@】rs.tus.ac.jp
学習院大学 理学部 物理学科 教授
西坂 崇之(にしざか たかゆき)
E-mail:takayuki.nishizaka【@】gakushuin.ac.jp
【報道・広報に関する問い合わせ先】
東京理科大学 経営企画部 広報課
TEL:03-5228-8107
FAX:03-3260-5823
E-mail:koho【@】admin.tus.ac.jp
学習院大学 大学学長室 広報センター
TEL:03-5992-1008
FAX:03-5992-9246
E-mail:koho-off【@】gakushuin.ac.jp
【@】は@にご変更ください。
