ニュース&イベント NEWS & EVENTS
ネオエキヌリンBおよび16種の誘導体の新規合成法の確立に成功
~C型肝炎ウイルスや新型コロナウイルスの抗ウイルス薬の開発に寄与~
東京理科大学
国立感染症研究所
麻布大学
お茶の水女子大学
研究の要旨とポイント
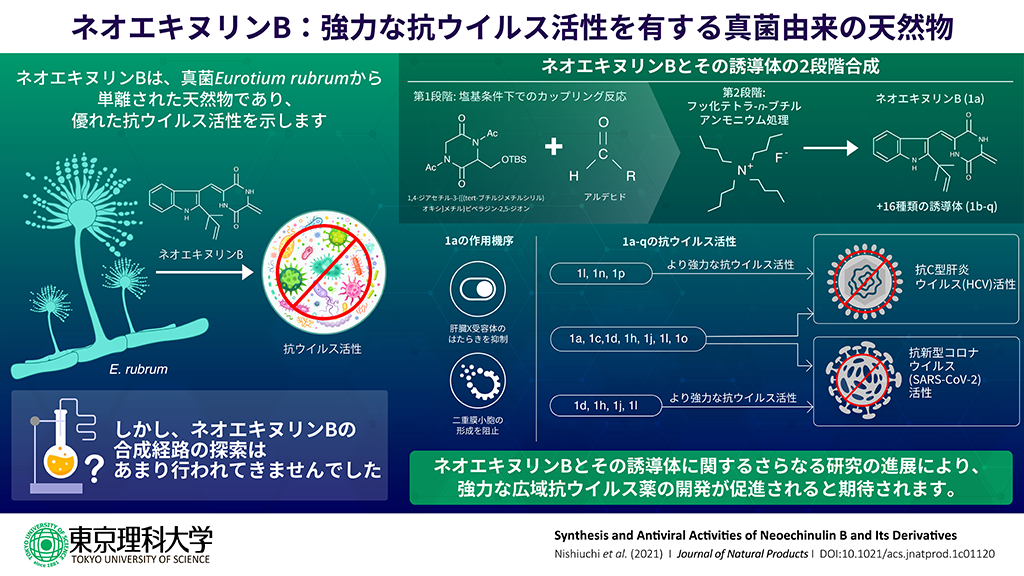
- ネオエキヌリンBはC型肝炎ウイルスやポリオウイルスに対して抗ウイルス活性を示す天然物として知られていますが、合成例が非常に少なく、高効率な新規合成法の確立が課題でした。
- ネオエキヌリンBのほか、16種の誘導体(うち15種は新規化合物)の合成およびその合成法の確立に成功しました。これらの化合物の多くが、C型肝炎ウイルスや新型コロナウイルスに対して抗ウイルス活性を示しました。
- 本研究を発展させることで、様々な感染症治療に適用できる新しい抗ウイルス薬の開発が期待されます。
東京理科大学理工学部応用生物科学科の倉持幸司教授、友重秀介助教(現:東北大学 大学院生命科学研究科)、大金賢司助教(現:お茶の水女子大学 基幹研究院自然科学系/理学部化学科)、国立感染症研究所治療薬・ワクチン開発研究センターの渡士幸一 治療薬開発総括研究官(兼任:東京理科大学大学院 理工学研究科応用生物科学専攻 客員教授)、大橋啓史博士、麻布大学獣医学部/ヒトと動物の共生科学センターの紙透伸治准教授らの研究グループは、ネオエキヌリンBと16種の誘導体(うち15種は新規化合物)の合成および合成法の確立に成功しました。また、これらの化合物の多くが、C型肝炎ウイルス(HCV)または新型コロナウイルス(SARS-CoV-2)に対して抗ウイルス活性を示すことを実証しました。本研究を発展させることで、様々なウイルスに対して有効な抗ウイルス剤開発への貢献が期待されます。
ネオエキヌリンBは肝臓X受容体(LXR)のはたらきを抑制することで、一部のRNAウイルス複製に共通して必要な二重膜小胞(DMVs)の形成を阻止します。そのため、複数のウイルスに対する抗ウイルス活性が期待される重要な化合物です。また、その誘導体も抗ウイルス活性が期待できるリード化合物として注目されてきました。一方で、ネオエキヌリンBの合成例は非常に少なく、広く使用可能な合成法が確立されていないことが課題でした。そこで、本研究グループはネオエキヌリンBおよびその誘導体の合成法の確立と抗ウイルス活性の評価を目的として、研究を行いました。
様々な検討の結果、2段階の反応を用いることで、ネオエキヌリンBと16種の誘導体の合成に成功しました。得られた化合物の抗HCV活性を調べたところ、16種すべての誘導体がネオエキヌリンBよりも高い活性を示しました。また、ネオエキヌリンBと6種の誘導体が抗SARS-CoV-2活性を示すことを実証し、うち5種の誘導体はネオエキヌリンBよりも優れた活性を有することがわかりました。今後のさらなる研究の発展によって、多くの感染症に効果のある新たな抗ウイルス薬の実現が期待されます。
本研究成果は、2021年12月30日に国際学術誌「Journal of Natural Products」にオンライン掲載されました。
研究の背景
ネオエキヌリンBは真菌Eurotium rubrumから単離された天然物であり、HCVやポリオウイルスに対して抗ウイルス活性を有することが知られていました。抗ウイルス薬として有用性が確認されているにも関わらず、ネオエキヌリンBの報告例は非常に少なく、構造と性質に関する系統的な研究もおこなわれてきませんでした。本研究グループは、過去の膨大な研究データから、ネオエキヌリンBと同様の分子骨格を有する化合物は、ネオエキヌリンBと同等、もしくはそれ以上の優れた抗ウイルス活性を示す可能性があると予想しました。さらに、ネオエキヌリンBには LXRのはたらきを抑制する性質があることから、ネオエキヌリンBの誘導体を評価することで抗ウイルス活性のメカニズムの解明にもつながるのではないかと考えました。
そこで本研究では、ネオエキヌリンBだけでなくその誘導体にも焦点を当て、それらの合成法の確立と合成した化合物の抗ウイルス活性の評価による作用機序の解明を目的としました。
研究結果の詳細
最初に、新規合成法の確立を行いました。出発原料であるアルデヒドとジケトピペラジン化合物を①カリウムtert-ブトキシド(t-BuOK)、②フッ化テトラ-n-ブチルアンモニウム (TBAF)のそれぞれの条件下での2段階の反応を経ることにより、目的化合物の合成を達成しました。そして、出発原料のアルデヒドの置換基を系統的に変化させることにより、ネオエキヌリンB および16種類もの多くの誘導体を得ることに成功しました。このうち、15種は新規化合物でした。誘導体の収率については、導入した置換基の種類により大きく異なりますが、およそ51~94%でした。ネオエキヌリンBの収率については、第1段階の反応を4回繰り返すと合計14%と極端に低くなります。これは分子の立体障害が原因であると考えられ、今後、改善が必要です。一方、ネオエキヌリンBについては、抽出や精製の過程でバリエコロリンHに構造変化していることも判明しました。
次に、ネオエキヌリンB、16種の誘導体、バリエコロリンH、ネオエキヌリンA、プレエキヌリンの計20種の化合物に関して、HCVとSARS-CoV-2に対する抗ウイルス活性の評価を行いました。抗HCV活性に関しては、ネオエキヌリンBと16種の誘導体すべてが有していることがわかりました。また、16種すべての誘導体がネオエキヌリンBよりも優れた活性を示すことがわかりました。さらに、分子構造の比較により、エキソメチレン部位や芳香環の電子密度が抗HCV活性に重要な役割を果たしていることが示唆されました。抗SARS-CoV-2活性に関しては、ネオエキヌリンB と6種の誘導体が有していることが明らかとなりました。また、そのうちの5種はネオエキヌリンBよりも強力な抗SARS-CoV-2活性を示しました。分子の構造的特徴と抗SARS-CoV-2活性との明確な関係は未解明のままですが、現時点では複数の異なる作用機序によってSARS-CoV-2の複製が抑制されていると考えられています。
本研究を通して、ネオエキヌリンBが抗ウイルス薬の開発における有望なリード化合物の1つであることが強く示唆されました。基本的に、ネオエキヌリンB はLXRを標的とすることでHCVの増殖を抑制します。しかしながら、抗HCV活性を示した化合物の中でもLXRに対して不活性なものもあることから、この化合物が異なる作用機序によって、抗HCV活性を示した可能性が考えられます。今後、抗ウイルス活性を改善するための構造最適化と、作用機序を解明するための研究を進めていく必要があります。
本研究の成果に関して、東京理科大学の倉持教授は「ネオエキヌリンBとその誘導体の合成が可能な新規合成法の確立を目指して取り組んできました。ネオエキヌリンBはHCV、ポリオウイルス、SARS-CoV-2といった一本鎖(+)鎖RNAウイルスに対して抗ウイルス活性を示すことがわかりました。つまり、本化合物は複数のウイルスに対して抗ウイルス活性を示すので、様々なウイルス感染症治療に汎用的に用いられる広域抗ウイルス薬としての用途が期待できます。今回、ネオエキヌリンBの分子構造の単純化とより強い抗ウイルス活性をもつ新規化合物の創製を実現できたため、実用化に一歩近づいたと言えます」と話しています。
・AMED「新興・再興感染症に対する革新的医薬品等開発推進研究事業(新型コロナウイルス感染症(COVID-19)に対する研究)」(JP20fk0108511;代表:渡士、分担:倉持、大金)
・AMED「肝炎等克服実用化研究事業」((JP20fk0210036;代表:渡士、分担:倉持、紙透)
・東京理科大学学内助成制度 三井住友信託銀行株式会社が立ち上げた「新型コロナワクチン・治療薬開発寄付口座」からの助成金(代表:倉持、分担:大金、渡士)
論文情報
雑誌名
Journal of Natural Products
論文タイトル
Synthesis and Antiviral Activities of Neoechinulin B and Its Derivatives
著者
Kota Nishiuchi, Hirofumi Ohashi, Kazane Nishioka, Masako Yamasaki, Masateru Furuta, Takumi Mashiko, Shusuke Tomoshige, Kenji Ohgane, Shinji Kamisuki, Koichi Watashi, and Kouji Kuramochi
DOI
発表者
西内 宏太 東京理科大学大学院 理工学研究科 応用生物科学専攻 2020年度 修士課程修了<筆頭著者>
大橋 啓史 国立感染症研究所 治療薬・ワクチン開発研究センター 研究員
西岡 華実 東京理科大学大学院 理工学研究科 応用生物科学専攻 2019年度 修士課程修了
山崎 雅子 東京理科大学大学院 理工学研究科 応用生物科学専攻 修士課程2年生
古田 将照 東京理科大学大学院 理工学研究科 応用生物科学専攻 修士課程2年生
増子 巧 東京理科大学 理工学部 応用生物科学科 2019年度 卒業
友重 秀介 東京理科大学 理工学部 応用生物科学科 助教(現:東北大学 大学院生命科学研究科)
大金 賢司 東京理科大学 理工学部 応用生物科学科 助教(現:お茶の水女子大学基幹研究院自然科学系/理学部化学科)
紙透 伸治 麻布大学獣医学部/ヒトと動物の共生科学センター 准教授
渡士 幸一 国立感染症研究所 治療薬・ワクチン開発研究センター 治療薬開発総括研究官、東京理科大学大学院 理工学研究科 応用生物科学専攻 客員教授
倉持 幸司 東京理科大学 理工学部 応用生物科学科 教授 <責任著者>
お問い合わせ
【研究に関する問い合わせ先】
東京理科大学 理工学部 応用生物科学科 教授
倉持 幸司(くらもち こうじ)
E-mail:kuramoch【@】rs.tus.ac.jp
国立感染症研究所 治療薬・ワクチン開発研究センター 治療薬開発総括研究官
渡士 幸一(わたし こういち)
E-mail:kwatashi【@】nih.go.jp
お茶の水女子大学 基幹研究院 自然科学系(理学部 化学科)講師
大金 賢司(おおがね けんじ)
E-mail:ohgane.kenji【@】ocha.ac.jp
麻布大学 獣医学部/ヒトと動物の共生科学センター 准教授
紙透 伸治(かみすき しんじ)
E-mail:kamisuki【@】azabu-u.ac.jp
【報道・広報に関する問い合わせ先】
東京理科大学 広報部 広報課
TEL:03-5228-8107 FAX:03-3260-5823
E-mail:koho【@】admin.tus.ac.jp
国立感染症研究所 総務部 調整課
E-mail:info【@】nih.go.jp
麻布大学 広報課(担当:有嶋・檜垣)
TEL:042-769-2032
E-mail:koho【@】azabu-u.ac.jp
お茶の水女子大学 企画戦略課(担当:髙取)
TEL:03-5978-5105
E-mail:info【@】cc.ocha.ac.jp
【@】は@に置き換えてください。
研究室
倉持研究室のページ:https://www.rs.tus.ac.jp/kuramoch/
倉持教授のページ:https://www.tus.ac.jp/academics/teacher/p/index.php?3bd3
東京理科大学について
東京理科大学:https://www.tus.ac.jp/
詳しくはこちら
