ニュース&イベント NEWS & EVENTS
がん免疫療法薬剤の新たな評価系となるモデルマウスの作製に成功
~腫瘍特異的T細胞応答への影響の正確な評価が可能に~
研究の要旨とポイント
- 免疫チェックポイント阻害剤による抗腫瘍免疫応答の活性化を定量的に評価する手法として、腫瘍反応性T細胞の応答を網羅的に解析できるT細胞受容体(TCR)レパトア解析が注目されていますが、治療前後でのTCRレパトアの変化と治療応答の関連を解析する適切な動物モデルがないという課題がありました。
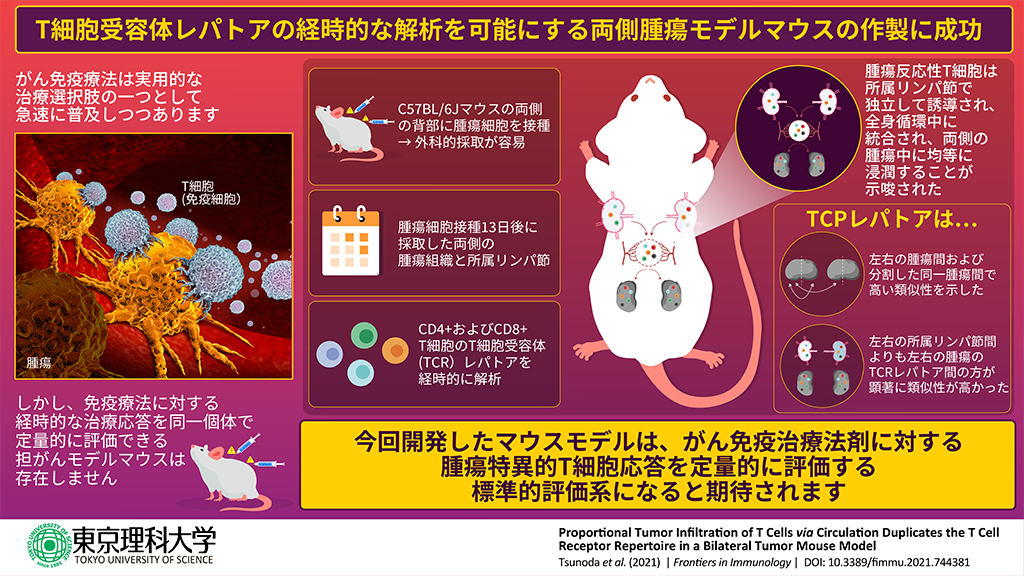
- 本研究では、両側の背部へ腫瘍細胞を皮下接種した両側腫瘍モデルマウスを作製し、両側の腫瘍のTCRレパトアは高い類似性を示すことを確認しました。
- この結果は、片側を治療前、残りを治療後に採取することで、TCRレパトアの変化と治療応答の関連を定量的に評価できることを意味しており、両側腫瘍モデルマウスを用いたTCRレパトアはがん免疫治療法の新しい評価系として有望であることがわかりました。
東京理科大学研究推進機構生命医科学研究所の松島綱治教授、上羽悟史准教授、薬学部生命創薬科学科分子医科学教室の角田樹也氏、東京大学大学院医学系研究科衛生学教室の青木寛泰氏(博士課程3年)の研究グループは、がん免疫療法の治療薬である免疫チェックポイント阻害剤(ICI)の効果を評価できる実験モデルとして、両側の背部へ腫瘍細胞を皮下摂取した両側腫瘍モデルマウスを作製しました。両側の腫瘍に対して、腫瘍反応性T細胞応答を特異的かつ定量的に評価するT細胞受容体(TCR)レパトア解析を行ったところ、左右の腫瘍のTCRレパトアが、分割した同一腫瘍と同等の類似性を持つことが分かりました。この結果から、両側腫瘍モデルマウスの片側をICI治療介入前、残りを治療介入後に採取し、TCRレパトアと腫瘍体積の変化をそれぞれ解析し相関を見ることで、ICI投与によるTCRレパトアの変化と抗腫瘍効果の関連を定量的に評価できることが示されました。
ICIは、がん免疫療法の実用的な治療薬として開発され、さらなる発展が期待されています。近年、このような免疫療法の効果を定量的に評価する手法として、抗原特異的なT細胞の応答を網羅的に解析可能なTCRレパトア解析が注目されています。しかしながら、担がんモデル動物として頻用されるマウスでは、TCRレパトア解析のために十分な量のサンプルを同一個体から複数回採取することは生体への侵襲性が高く困難であり、TCRレパトア解析を用いた薬効評価や詳しい作用機序の解明を行うのに適切な動物実験モデルがない状況です。
研究グループは、両側腫瘍モデルマウスの各腫瘍が分割した同一腫瘍と同等の類似性を持つことを明らかにしました。これは、片側を治療介入前、残りを治療介入後に採取し、解析に用いることで、治療介入によるTCRレパトア変動を定量的に評価可能であることを意味します。このモデルマウスが、腫瘍特異的T細胞の応答を定量的に解析するスタンダードな評価系として、新たながん免疫治療法剤の開発研究に貢献することが期待されます。
本研究成果は、2021年10月25日に国際学術誌「Frontiers in Immunology」にオンライン掲載されました。
研究の背景
ICIは、一部のがんに対して大きな治療効果を発揮するため、近年、がん治療の重要な柱となっています。しかし、単独療法の奏効率は30%未満であり、作用機序や治療応答の評価系の開発が求められてきました。ICIの有効性と密接に関連しているのが、腫瘍特異的なT細胞応答の強さです。腫瘍特異的T細胞クローンは非常に多様であり、その多様性はT細胞受容体(TCR)によって決まっています。TCRレパトア解析は、ICI投与による腫瘍特異的T細胞応答をモニターし、効果を判定するために応用できます。しかし、適切な動物実験モデルがないことから経時的なモニタリングと比較が困難であったため、免疫療法によるTCRレパトアの変化と抗腫瘍T細胞応答の因果関係は、これまで明らかにできませんでした。
TCRレパトアと抗腫瘍反応の因果関係を明らかにするためには、個々のマウスにおける経時的なモニタリングが必要です。先行研究では、免疫微小環境が類似し、腫瘍の成長が同程度の両側腫瘍モデルであれば、抗腫瘍免疫応答の経時的解析へ応用できる可能性が示唆されていました。そこで、研究チームでは、治療介入によるTCRレパトア変動の定量的評価を実現する前提条件として、左右の腫瘍のTCRレパトアが類似の特性を示すことと、同じ腫瘍反応性T細胞クローンが両側の腫瘍に浸潤していること、の二点を示す必要があると考え、研究を行いました。
研究結果の詳細
まず、マウスの両背部皮下への腫瘍細胞接種により両側腫瘍マウスを作出し、腫瘍体積の測定により、両側腫瘍の対称的に成長することを確認しました。これは、同様の抗腫瘍反応が両側で起こっていることを示唆しています。また、腫瘍抗原が流入する所属リンパ節(dLN)は腫瘍特異的なT細胞の活性化や増殖を誘導する重要な免疫組織であることから、腫瘍だけでなくエバンスブルー染色で確認した両側のdLNについても、TCRレパトア解析を行いました。
腫瘍細胞接種13日後のマウスから両側の腫瘍とdLNを採取し、腫瘍からCD4+およびCD8+ T細胞、dLNからCD4+ CD44hi およびCD8+ CD44hi T細胞を調整し、それらのTCRレパトアを分析しました。その結果、T細胞クローンの頻度分布や構成するクローンが両側腫瘍間で高度に保存されていたことなど、両側腫瘍のTCRレパトアの特徴が類似していることを確認しました。
また、この個体内の腫瘍間のTCRレパトアの類似性は、分割した同一腫瘍同士の類似性と同等であったことから、両側腫瘍モデルにおける経時的腫瘍サンプリングは、臨床で行う治療介入前後の腫瘍生検を用いたTCRレパトアの経時的モニタリングのモデルとなりうることが示唆されました。
一方、両側dLNに誘導された腫瘍反応性T細胞クローンは、中程度にしか保存されておらず、TCRレパトアの類似性は両側腫瘍同士の類似性に比べ、明らかに低いことがわかりました。これは、両側dLNで独立して誘導された腫瘍反応性T細胞クローンが全身循環中で統合され、両側の腫瘍中に均等に浸潤していることを示唆しています。独立した腫瘍であっても、腫瘍部位で起きる免疫応答が類似している可能性を示すこの結果は、免疫学的・解剖学的に非常に興味深い知見と言えます。
以上の結果から、両側腫瘍マウスは、腫瘍反応性T細胞クローンの経時的変化および治療による変化を解析するモデルとして有望であることが示されました。この両側腫瘍モデルでは、同一個体内におけるT細胞クローンの拡大、収縮、消退の動態が明らかにできると予想されます。そのため、この新しい実験系は、腫瘍反応性T細胞の反応についての理解を深め、がん治療における免疫療法剤の開発・評価に貢献することが期待されます。
研究を行った上羽准教授は、「現在、世界中でさまざまな複合免疫療法の開発が進められていますが、治療法の作用機序や腫瘍特異的T細胞応答への影響が正確に示されているケースは極めてまれです。本研究により確立した両側腫瘍マウスモデルを用いたTCRレパトア解析は、腫瘍特異的T細胞応答を定量的に解析するスタンダードな評価系として、新たながん免疫治療法の開発研究に貢献するでしょう」と今後の抗がん剤研究への応用に期待を示しました。
※本研究は、日本学術振興会(20281832および17929397)、日本医療研究開発機構(JP 21gm6210025)の助成を受けて実施したものです。また、青木寛泰氏は岸本忠三フェローシッププログラムの支援を受けました。
論文情報
雑誌名
Frontiers in Immunology
論文タイトル
Proportional Tumor Infiltration of T Cells via Circulation Duplicates the T Cell Receptor Repertoire in a Bilateral Tumor Mouse Model
著者
Mikiya Tsunoda, Hiroyasu Aoki, Haruka Shimizu, Shigeyuki Shichino, Kouji Matsushima and Satoshi Ueha
DOI
研究室
松島研究室のページ:https://k-matsushimalab.org/
松島教授のページ:https://www.tus.ac.jp/academics/teacher/p/index.php?6FA1
上羽准教授のページ:https://www.tus.ac.jp/academics/teacher/p/index.php?7037
七野助教のページ:https://www.tus.ac.jp/academics/teacher/p/index.php?7039
東京理科大学について
東京理科大学:https://www.tus.ac.jp/
詳しくはこちら
