ニュース&イベント NEWS & EVENTS
細胞内抗体プローブを用いて
遺伝子の転写が活性化している細胞を生体内で特定することに成功
東京大学
山形大学
東京工業大学
科学技術振興機構
東京理科大学
1. 発表者:
澁田 未央(山形大学学術研究院(理学部担当) 助教/
研究当時:東京大学大学院新領域創成科学研究科先端生命科学専攻 特任研究員)
坂本 卓也(東京理科大学理工学部応用生物科学科 講師)
笠松 秀輔(山形大学学術研究院(理学部担当) 助教)
鈴木 孝征(中部大学応用生物学部応用生物化学科 准教授)
佐藤 優子(東京工業大学科学技術創成研究院細胞制御工学研究センター 助教)
木村 宏(東京工業大学科学技術創成研究院細胞制御工学研究センター 教授)
松永 幸大(東京大学大学院新領域創成科学研究科先端生命科学専攻 教授)
2. 発表のポイント:
- ◆植物体内で抗体の一部(細胞内抗体プローブ、注1)を発現させることで、遺伝子の転写が活性化している細胞を特定できるようになった。
- ◆遺伝子を転写活性化させるメカニズムは動物と植物で共通性があることがわかった。
- ◆生体内の器官や組織の中で活性化している特定の細胞を操作・制御する技術開発に貢献することが期待される。
3. 発表概要:
真核生物のタンパク質をコードする遺伝子はRNAポリメラーゼII(RNAPII、注2)によって転写されてRNAを作り出します。RNAPIIはリン酸化されることで活性化しますが、その活性化の研究は、器官・組織・細胞を固定して解析する生化学的手法が主流でした。そのため、RNAPIIが活性化している細胞の生体内での空間的位置や転写の開始や停止のタイミングなどの情報は不明なままでした。
山形大学学術研究院の澁田未央助教、東京理科大学理工学部応用生物科学科の坂本卓也講師、東京工業大学科学技術創成研究院の木村宏教授、東京大学大学院新領域創成科学研究科の松永幸大教授らは、RNAPIIの活性化状態を生きた植物で解析する手法を開発しました。この解析手法の開発により、生体内で遺伝子発現が活性化している細胞を特定できるようになりました。また、RNAPIIの活性化メカニズムは動植物で共通していることを示しました。この研究成果は、器官や組織を傷つけずに活性化細胞を操作・制御する手法の開発に道を開くとともに、有用な植物由来物質を動物細胞内で生産させるために、植物ゲノムを動物細胞に移植した際に転写を活性化させる技術開発に貢献することが期待されます。
本研究成果は、2021年5月14日付けで国際科学雑誌「Communications Biology」のオンライン版に掲載されました。
本研究は、科学技術振興機構(JST)CREST「異種ゲノム制御による光合成作動細胞の創製」(JPMJCR20S6)、文部科学省科学研究費・新学術領域「不均一環境変動に対する植物のレジリエンスを支える多層的情報統御の分子機構」(20H05911)、「細胞システムの自律周期とその変調が駆動する植物の発生」(20H05425)、基盤研究B(19H03259)、基盤研究C(19K06748)、若手研究(20K15836)、三菱財団自然研究科学研究助成、ノバルティス科学振興財団研究奨励金などのもとで実施されました。
4. 発表内容:
RNAポリメラーゼII (RNAPII)という酵素によって、動物や植物の遺伝子は転写されてRNAが作られます。この時、RNAPIIの特定のアミノ酸残基にリン酸基が導入されるリン酸化によって、RNAPIIの活性状態が変化することは以前より知られていました。つまり、RNAPIIのリン酸化状態を知ることができれば、遺伝子の転写の活性化を知ることができます。これまでは、このRNAPIIのリン酸化を認識する抗体を、固定した細胞群に反応させ、生化学的解析や免疫染色法による細胞生物学的解析が行われてきました。しかし、生きた組織や器官のRNAPIIのリン酸化状態を知る手法は開発されておらず、組織や器官の細胞ごとの遺伝子転写の活性化度合をモニタリングすることは困難でした。
今回、マウスで作製されたRNAPIIの2番目のセリン残基に導入されたリン酸基(RNAPIISer2P、注3)を検出するために、マウス抗体の一部分に蛍光タンパク質を融合させた細胞内抗体プローブを、モデル植物であるシロイヌナズナ体内で発現させ、RNAPIIの2番目のセリン残基のリン酸化状態をリアルタイムで可視化しました(図1、2)。この可視化した植物体を生化学的に解析することで、RNAPIISer2Pは転写開始と同時に、核内で検出され始め、転写の終結点で最大となり、遺伝子転写活性化の指標になり得ることがわかりました。この生化学的手法により、植物体内で発現した細胞内抗体プローブは、RNAPIISer2Pと結合して、RNAPIIの転写活性化状態をイメージングしていることを証明しました。
次に、細胞内抗体プローブの蛍光強度を生きた根の細胞ごとにライブイメージング解析(注4)しました。シロイヌナズナの根は、外側から表皮、皮相、内皮、内鞘が同心円状に配列しています。いずれの細胞でも細胞内抗体プローブの蛍光が観察されましたが、特に内鞘細胞で蛍光輝度が高いことがわかりました。このことから、根の細胞の中で、維管束の周りにある内鞘細胞で、遺伝子の転写が最も活性化されていることがわかりました。また、組織内の生きた細胞をライブイメージング解析することで、分裂中の細胞では細胞内抗体プローブの蛍光強度が減少することから、細胞分裂に入るとともに、遺伝子の転写は抑制されることも明らかになりました(図3)。この植物の細胞分裂において見られたRNAPIISer2Pの動態は、すでに報告があった動物培養細胞の細胞分裂における動態と同じでした。
今回の研究成果により、遺伝子の発現が活性化している細胞を生体内で特定することができるようになりました。この手法により、遺伝子の発現が活性化している特定の細胞を操作することができ、例えば活性化細胞だけを狙い撃ちして不活性化させれば、特定の組織や器官全体を切除、変形させる必要がなくなります。逆に、特定の細胞だけを活性化させ、代謝を活性化したり、形態形成を促進・修復したりすることが可能になると期待されます。
また、今回の研究成果は、マウスのRNAPIISer2P認識抗体の一部の遺伝子から植物体内で転写・翻訳された細胞内抗体が植物細胞内で機能することを示しました。また、動物と植物においてRNAPIIのリン酸化による転写活性化メカニズムには共通性があることを示しました。このことは、植物ゲノムを動物細胞に導入した際に、動物のRNAPIIによって植物ゲノムの転写が可能であることを示唆しています。今後、有用な植物由来物質を動物細胞内で生産させるために、植物ゲノムを動物細胞に移植して遺伝子発現させるための手法開発に役立つことが期待されます。
5. 発表雑誌:
雑誌名
Communications Biology(オンライン版:5月14日)
論文タイトル
A live imaging system to analyze spatiotemporal dynamics of RNA polymerase II modification in Arabidopsis thaliana
著者
Mio K. Shibuta, Takuya Sakamoto, Tamako Yamaoka, Mayu Yoshikawa, Shusuke Kasamatsu, Noriyoshi Yagi, Satoru Fujimoto, Takamasa Suzuki, Satoshi Uchino, Yuko Sato, Hiroshi Kimura and Sachihiro Matsunaga*
DOI番号
URL
6. 問い合わせ先:
<研究に関すること>
東京大学大学院新領域創成科学研究科先端生命科学専攻 統合生命科学分野
教授 松永 幸大(まつなが さちひろ)
Tel:04-7136-3706
E-mail:sachi【@】edu.k.u-tokyo.ac.jp
<報道に関すること>
東京大学大学院新領域創成科学研究科 広報室
Tel:04-7136-5450
E-mail:press【@】k.u-tokyo.ac.jp
山形大学 総務部総務課秘書広報室
Tel:023-628-4008
E-mail:koho【@】jm.kj.yamagata-u.ac.jp
東京理科大学 広報部広報課
Tel:03-5228-8107
E-mail:koho【@】admin.tus.ac.jp
東京工業大学 総務部広報課
Tel:03-5734-2975
E-mail:media【@】jim.titech.ac.jp
科学技術振興機構 広報課
Tel:03-5214-8404
E-mail:jstkoho【@】jst.go.jp
<JSTの事業に関すること>
保田 睦子(やすだ むつこ)
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
Tel:03-3512-3524
E-mail:crest【@】jst.go.jp
【@】は@にご変更ください。
7. 用語解説:
(注1)細胞内抗体プローブ
遺伝子組み換え技術を用いて、抗体の抗原を認識する部位と蛍光タンパク質を融合させて作った人工のプローブ。細胞内で発現させることにより、特定の抗原を生きた細胞内で観察できる。
(注2)RNAポリメラーゼII (RNAPII)
真核細胞のタンパク質をコードする遺伝子(DNA)をRNAに転写する酵素。さらにRNAからタンパク質へと翻訳される。
(注3)RNAPIISer2P
RNAPIIの2番目のセリンがリン酸化された状態。RNAPIIは5番目のセリンがリン酸化されると転写開始点に配置され、2番目のセリンのリン酸化と5番目のセリンの脱リン酸化が進みながら伸長反応が進み、転写終結点において2番目のセリンが最もリン酸化された状態になる。
(注4)ライブイメージング解析
細胞・組織・器官・生体を生きたままの状態で可視化し、顕微鏡を用いて解析すること。本研究では蛍光顕微鏡を用いて、蛍光タンパク質を融合させた抗体を観察することで、抗原修飾タンパク質の動態を解析した。
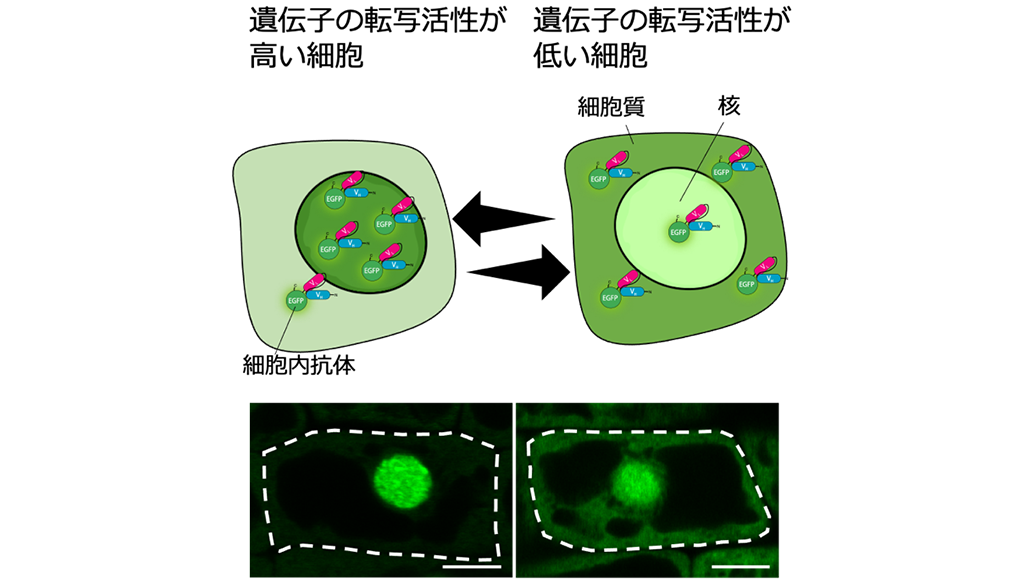 |
図1 RNAPIISer2Pを認識する細胞内抗体プローブによる転写活性化のモニタリング
緑色蛍光タンパク質と融合した細胞内抗体プローブは、細胞質で翻訳されて局在する。転写活性が高い細胞は細胞核内のRNAPIISer2Pが増えるため、多くの細胞内抗体プローブが細胞核内に捕捉され、細胞核内の蛍光輝度が上昇する。転写活性が低い細胞は、細胞内抗体プローブが細胞核内に捕捉される量が少なく、細胞質の蛍光輝度が上昇する。白い破線が植物細胞の細胞壁を示す(スケールバーは5 µm)。
 |
図2 遺伝子の転写活性をモニタリングするライブイメージングの原理
蛍光輝度の基準値として細胞核内に存在するヒストンタンパク質に赤色蛍光タンパク質を用い、細胞内抗体プローブの蛍光輝度と比較することで、RNAPIISer2P修飾状態の可視化法とした。
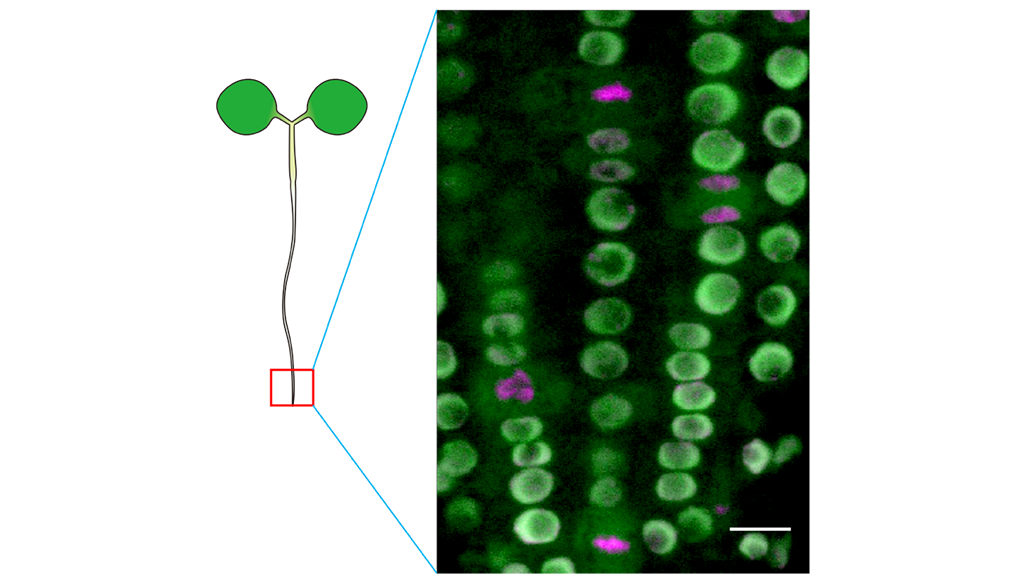 |
図3 RNAPIISer2Pを認識する細胞内抗体プローブを発現した植物の根のライブイメージング
蛍光顕微鏡写真中(右図)の緑色は細胞内抗体プローブ、すなわちRNAPIISer2Pを示す。細胞核ごとに蛍光輝度が異なり、転写活性に差があることがわかる。細胞核の内部の核小体は転写活性が低いため、蛍光輝度が低い。マジェンタ色は分裂中の細胞に見られる凝縮した染色体を示す。分裂中の細胞のRNAPIISer2Pの蛍光は細胞質に検出される。これは分裂中の細胞の転写活性が抑制されることを示している(スケールバーは10 µm)。
