ニュース&イベント NEWS & EVENTS
オキシトシンの分泌を制御するタンパク質を発見!
~自閉症の早期分子診断法や治療法開発に光~
研究の要旨とポイント
- 自閉症は社会的相互作用やコミュニケーションの欠損などを特徴とする発達障害の一種であり、高い有病率を示します。その発症メカニズムはまだ解明されていませんが、一部の自閉症患者では、神経ペプチドや生体アミンの分泌を促進するCAPS2と呼ばれるタンパク質の遺伝子変異などが確認されています。
- 本研究では、CAPS2が社会性を司る神経ペプチドとして注目されるオキシトシンの分泌制御に関与しており、それによって社会に関連していることを、マウスを用いた実験から明らかにしました。
- 本研究で明らかになったCAPS2を介したオキシトシン分泌制御機構は、自閉症の発症リスクや症状に関連している可能性があり、今後のさらなる研究によって自閉症の早期の分子診断法や有効な治療法の開発に繋がると期待されます。
東京理科大学理工学部応用生物科学科の古市貞一教授、藤間秀平(大学院生)、佐野良威嘱託講師、東京薬科大学の篠田陽准教授、群馬大学大学院医学系研究科の定方哲史准教授、新潟大学脳研究所の阿部学准教授、崎村健司フェローらの研究グループは、マウスを用いた実験から、CAPS2(※1)が「社会性神経ペプチド」や「愛情ホルモン」として注目されるオキシトシン(※2)の分泌を制御し、社会性行動障害にも関係していることを明らかにしました。
本研究成果は、2021年5月19日にJournal of Neuroscience電子版に掲載されました。
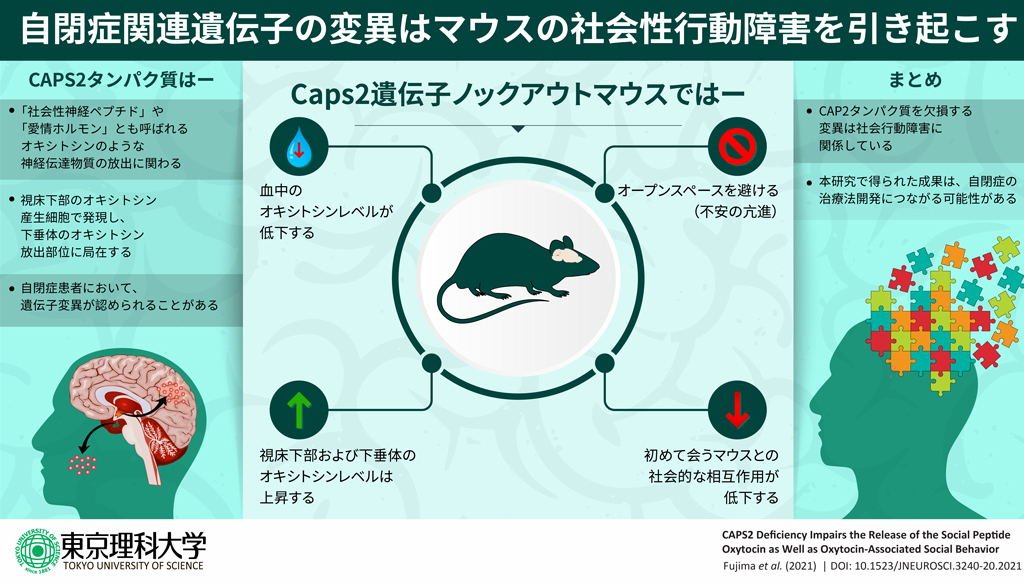
CAPS2は、神経ペプチドや生体アミン(ドーパミンやノルエピネフリンなど)の分泌を調節するタンパク質です。これまでに研究チームは、一部の自閉症患者がCAPS2に異常をもつことに加え、CAPS2がオキシトシンを作り出す視床下部の神経細胞で発現しその細胞が神経線維を伸長して血中への分泌を行う脳下垂体にも存在していることを突き止めています。さらに、Caps2遺伝子欠損マウスが自閉症モデルとなる行動障害を示すことから、「CAPS2がオキシトシンの分泌制御を調節し、その結果社会性行動にも関与している」という仮説を立て、本研究に取り組みました(図1)。
CAPS2の組織細胞分布の解析や血中のオキシトシン濃度の測定、社会的相互作用テスト(※3)を行った結果から、CAPS2が、オキシトシンの血中への分泌に不可欠であり、実際にオキシトシン由来の社会性行動の制御にも関係していることが明らかになりました。本研究は自閉症の早期の分子診断法や有効な治療法の開発に繋がる重要な成果です。
研究の背景
自閉症(あるは、自閉スペクトラム症)は、社会的な相互作用やコミュニケーションの障害、および興味の限局と常同行動を特徴とする神経発達障害の一つで、人口100人当たり1人以上の高い有病率が各国で報告されています。改善しても完治はしないことから患者本人だけでなく家族への負担が大きく、深刻な社会問題となっていますが、その発症メカニズムはまだ解明されていません。
これまでに研究チームは、一部の自閉症患者においてCAPS2遺伝子の選択的スプライシング(※4)に異常があることなどを明らかにし、2012年には自閉症で発見された部分欠失型のCAPS2を発現するマウス(自閉症モデルマウス)の作製にも成功しました。
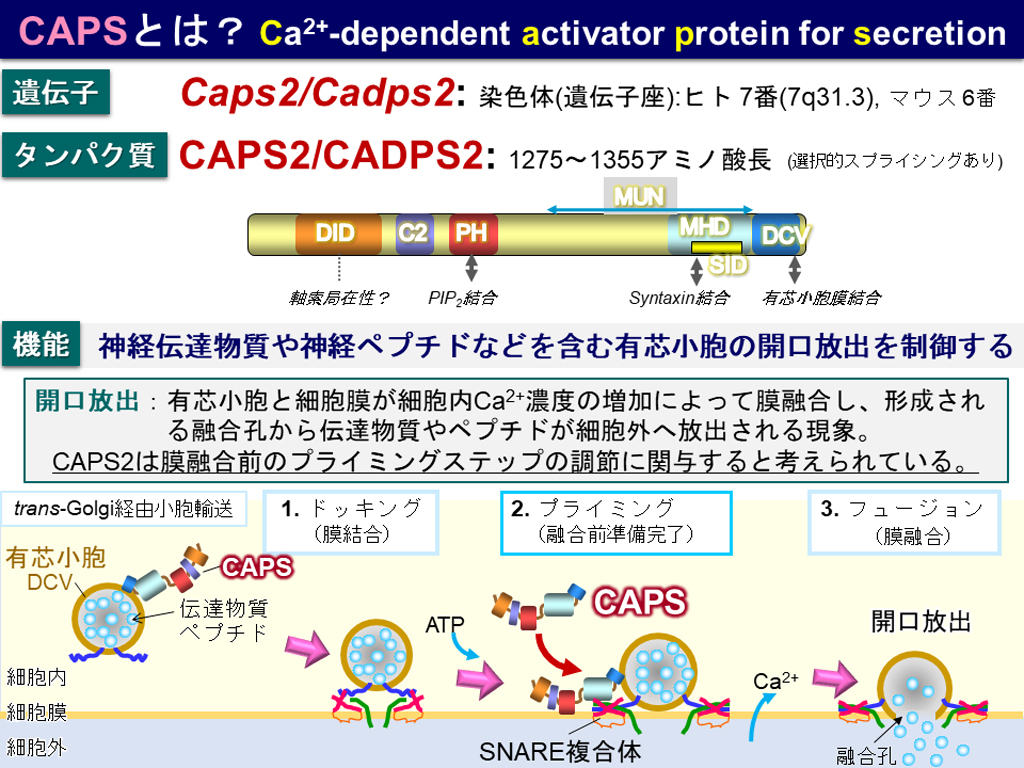
CAPS2は、神経ペプチドやペプチドホルモン、およびアミン系神経伝達物質(ドーパミンやノルエピネフリンなど)などを内包する有芯小胞の開口放出を促進して、ペプチド作動性およびカテコールアミン作動性の情報伝達に関係します(図2)。マウスにおけるCAPS2の欠損は、一部の神経細胞の成熟や生理機能への影響としては軽度ですが、社会行動を損ない不安を亢進します。稀に見られるde novoのCaps2遺伝子の一塩基変異やコピー数変異は、一部の自閉スペクトラム症でも検出されています。しかし、「CAPS2を介した分泌機構が、どのように社会行動に関与しているか」、そして、「どの分泌性物質が欠損したCAPS2の影響を受けて自閉症に関与しているのか」は未だ明らかではありませんでした。
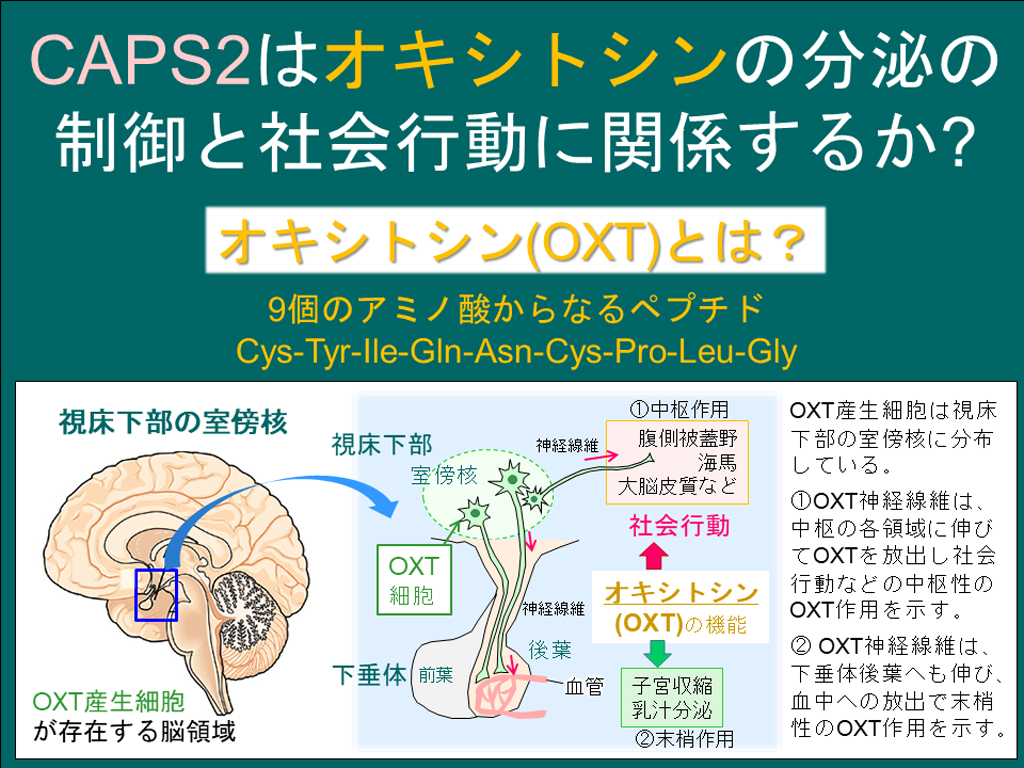
研究チームは、これまでの研究から、オキシトシンの産生部位である視床下部と血中への分泌部位である脳下垂体でCAPS2タンパク質が存在していることを突き止めています。オキシトシンは不安の軽減、他者との交流といった社会性行動の調節に関与し、自閉症患者にオキシトシンを投与することで社会性行動障害の改善に繋がることが知られて注目されています。そこで「CAPS2がオキシトシンの分泌制御を調節し、その結果社会性行動にも関与しているのではないか」と仮設を立て、本研究に取り組みました。
研究結果の詳細
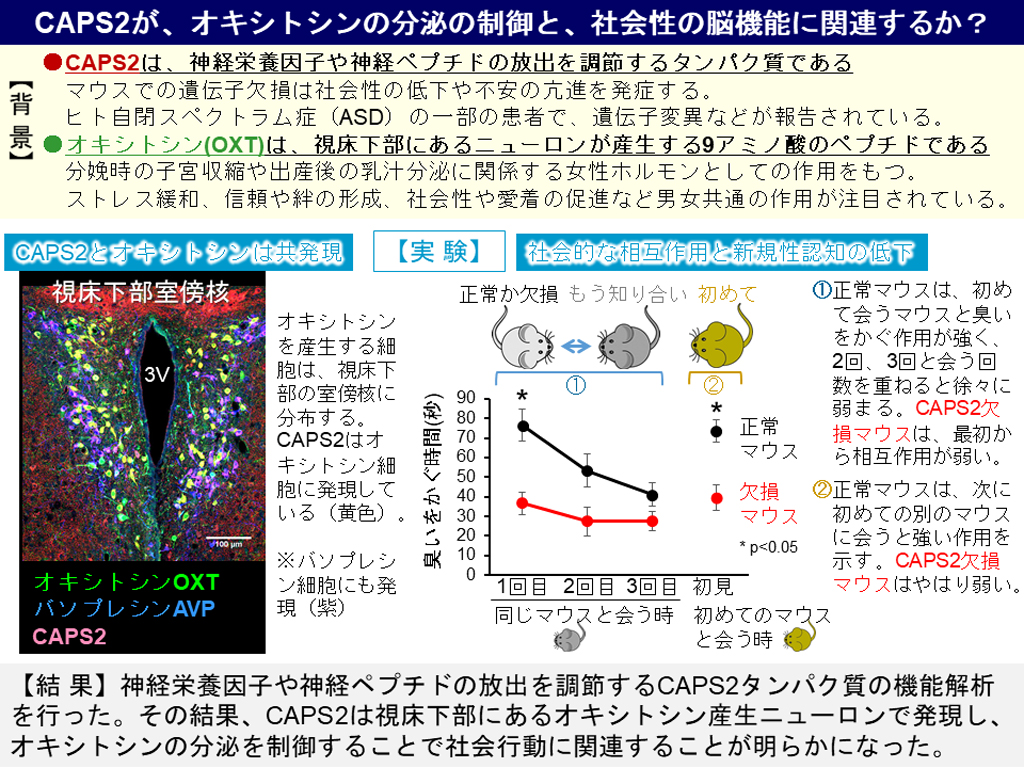
まず、研究チームは免疫組織化学染色(IHC)を行ってCAPS2が脳組織のどの部位に存在しているかを調べたところ、視床下部の室傍核のオキシトシン陽性神経細胞(および類似ペプチドのバソプレシンの陽性細胞)と、脳下垂体後葉の血管付近にCAPS2の存在が確認できました。この結果、オキシトシンは、視床下部の室傍核のオキシトシン産生細胞で作られ、その神経軸索を通り、脳下垂体後葉へ送られて血液中に分泌されることがわかっており、CAPS2は血液中へのオキシトシン分泌に関与している可能性が示されました。
次に、酸素免疫吸着法(ELISA)を用いて、CAPS2の欠損がオキシトシンの分泌量にどのような影響を与えるのか定量的に調べました。その結果、正常な個体と比べCAPS2を欠損させたマウス(CAPS2 KOマウス)では、血中のオキシトシン濃度が有意に低く、一方、視床下部室傍核と脳下垂体では高いことがわかりました。この実験結果は、CAPS2の欠損によりオキシトシン分泌活性が低下すると、視床下部室傍核や脳下垂体では細胞内に溜まるオキシトシン量が増えて、逆に血中へ分泌される末梢性のオキシトシン量が減少することを示唆しており、CAPS2はオキシトシン分泌に関与する可能性がさらに強まりました。オキシトシンの神経軸索は大脳皮質、海馬、腹側被蓋野などへも伸長して中枢性のオキシトシン分泌を行って社会性行動を制御すると考えられており、今回の研究では解析していませんが、おそらくCAPS2 KOマウス脳内の中枢性オキシトシン分泌量も同じように低下が予想されます。
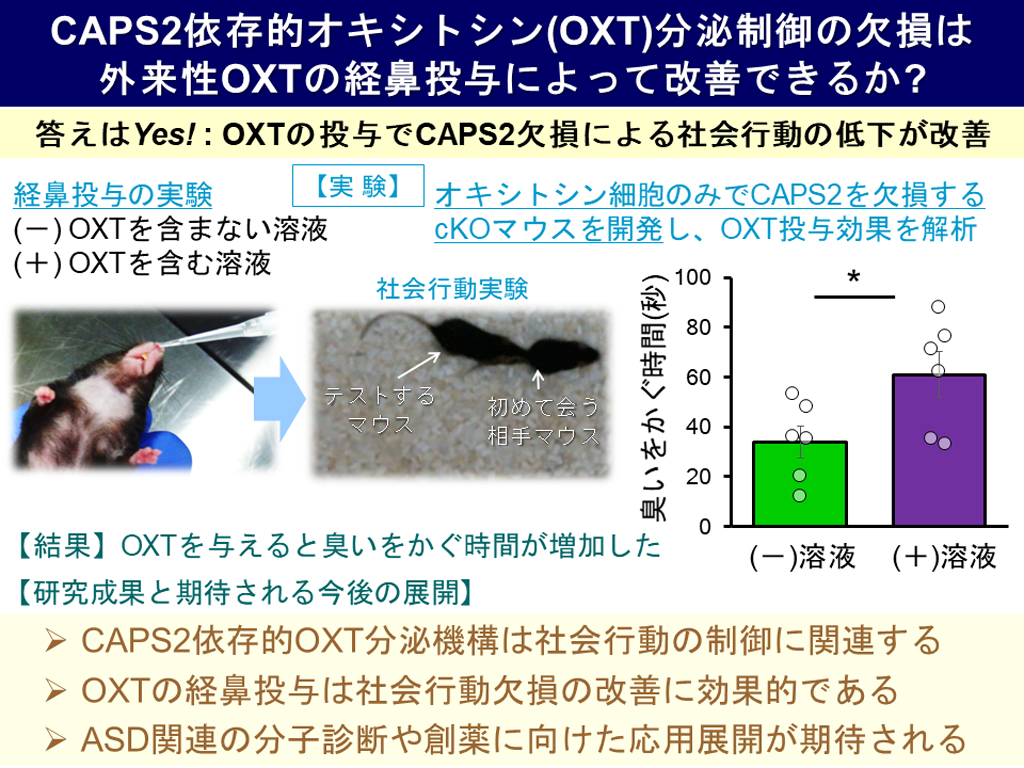
さらに、オキシトシンの投与によってCAPS2欠損による行動障害が改善されるのかを調べました。CAPS2 KOマウスでは、全体のCAPS2の発現が低下するためオキシトシン以外の様々な因子の分泌に異常が起こり、広範囲の細胞や行動に影響が起こることが予想されます。そこで、オキシトシン産生神経細胞でのみ条件的にCAPS2が欠損するマウス(CAPS2 cKOマウス)を作製・開発し、同じケージ(飼育箱)でこれまで飼育したことのない2匹の雄マウスをテスト箱に入れ、マウスの社会的相互作用(近づいて匂いを嗅いだり、接触したりする行動)を評価する社会性行動テストを行いました。その結果、テストするマウス(正常かcKOマウス)にとって侵入者となる相手マウスに対しての社会的相互作用の持続時間に有意な減少が見られ、社会性行動に障害があることがわかりました(図3)。
最後に、これまでにオキシトシンの経鼻投与によって血液中やいくつかの脳領域でのオキシトシン濃度が上昇し社会的な相互作用や絆の行動が増加することが人やマウスなどの動物モデルで明らかになっていることから、CAPS2 cKOマウスにオキシトシンの経鼻投与を行いました。すると予想通り、侵入者に対する尾部への嗅ぎ込みなどの相互作用時間が有意に増加し、障害に改善が見られました(図4)。
これらの結果から、CAPS2がオキシトシンの分泌制御を調節し、その結果社会性行動にも関与していることが明らかになりました。本研究はまだ基礎的段階ではありますが、将来的に早期の分子診断法や有効な治療法への応用展開が期待される重要な成果です。
※本研究は、日本学術振興会および文部科学省の科学研究費(17H03563、17K19638、26290026、15K14356、15K21013、15K08192)、公益財団法人ノバルティス科学振興財団の研究助成、および文部科学省新学術研究「包括型脳科学研究支援ネットワーク」の助成を受けて実施したものです。
また、本学の研究推進機構にあった「脳学際研究部門(BIRD)」と「ヒト疾患モデル研究センター」での研究活動の一環としても実施いたしました。
用語解説
※1 CAPS2(Ca2+-dependent activator protein for secretion 2)
CAPSファミリーのタンパク質は、CAPS2の他にCAPS1があり、有芯小胞と呼ばれる大型の分泌小胞に作用して、小胞内腔に含有する神経ペプチドや神経栄養因子(BDNFやNT-3)、および生体アミン(ドーパミン、ノルエピネフリンなど)の分泌を正に調節する役目を果たすことが知られています。
※2 オキシトシン
オキシトシンは、9アミノ酸からなる小さい生理活性ペプチドで、視床下部の室傍核や視索上核に分布するオキシトシン産生神経細胞で合成されます。オキシトシン産生神経細胞は、神経軸索(線維)を脳下垂体に伸長してオキシトシンを血中へ分泌し分娩時の子宮収縮やその後の乳汁分泌などを制御する末梢性の作用をもつほかに、大脳皮質、海馬、腹側被蓋野、側坐核、外側中核核などへも伸長してオキシトシンを脳内へ分泌しストレス緩和や社会性などを制御する中枢性の作用も示します(このことから「社会性神経ペプチド」や「愛情ホルモン」と称されます)。なお、バソプレシンは、オキシトシンとは2個だけアミノ酸の種類が異なる同じ9アミノ酸のペプチドで、室傍核の別のCAPS2発現細胞で合成され(図2)、社会性の認知への関与が示されています。この2つのペプチドの単離と合成の成功が1955年のノーベル化学賞の受賞対象となっています。
※3 社会相互作用テスト
同じケージで飼育したことのない2匹の雄マウスをテスト箱に入れ、マウスの社会的相互作用(近づいて匂いを嗅いだり、接触したりする行動)を評価しました。本リリースでは社会性行動を評価するマウスに対し、もう一方のマウスを「侵入者」と記載しています。
※4 選択的スプライシング
真核生物のゲノムDNA上にある遺伝子のタンパク質をコードする配列は、タンパク質へ翻訳されるエクソンと呼ばれる複数の配列と、その間をつなぐイントロンと呼ばれる配列から構成されています。遺伝子は、まず、エクソンとイントロンが一続きの前駆体mRNAに転写された後、イントロンが除去されエクソン同士が連結した成熟mRNAとなります(スプライシング)。遺伝子や細胞によっては、スプライシング反応の際に特定のエクソンをスキップした成熟mRNAを産生する場合があり、これによって性質の異なるタンパク質の鋳型が作られます(選択的スプライシング)。この結果、1つの遺伝子から働きの異なる複数のタンパク質が作られることが知られています。CAPS2ではエクソン3を欠失するCAPS2-dex3型の発現が一部の自閉症患者から発見され、CAPS2-dex3を発現するモデルマウスは社会性行動の障害の発症が確認されています(2012年12月5日 本学と群馬大学の共同プレスリリース)。
論文情報
雑誌名
Journal of Neuroscience
論文タイトル
CAPS2 deficiency impairs the release of the social peptide oxytocin, as well as oxytocin-associated social behavior
著者
Shuhei Fujima, Ryosuke Yamaga, Haruka Minami, Shota Mizuno, Yo Shinoda, Tetsushi Sadakata, Manabu Abe, Kenji Sakimura, Yoshitake Sano, Teiichi Furuichi
DOI
10.1523/JNEUROSCI.3240-20.2021
