ニュース&イベント NEWS & EVENTS
高い選択性でがん細胞を死滅させる天然化合物N-アルキルフェナジノンおよび誘導体を合成
~がんに対する新たな化学療法剤としての応用に強い期待~
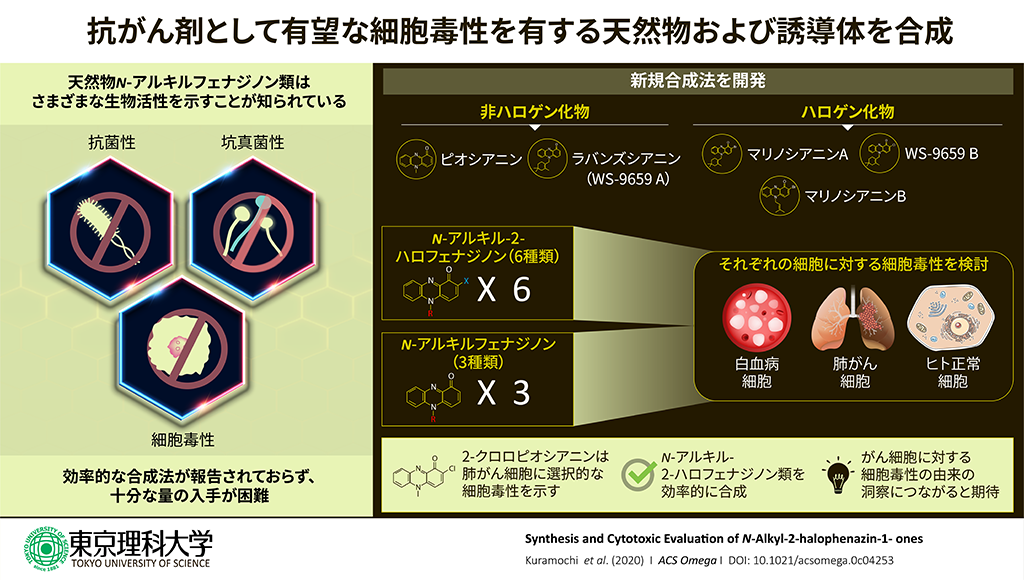
- ●天然化合物N-アルキルフェナジノン類はがん細胞に対する細胞毒性など有用な性質を持つため、医薬品としての活用が期待されており、簡便な化学合成法の開発が求められていました。
- ●これまで化学合成では得られていなかった天然化合物や非天然化合物を含む計9種のN-アルキルフェナジノン類を、酸素雰囲気下という穏和な条件かつワンステップの簡便な酸化的カップリング反応で合成することに成功しました。
- ●それらのうち、がん細胞に顕著に選択的に作用し死滅させる化合物を見出したため、抗がん剤としての応用を目指した今後の開発研究が強く期待されます。
東京理科大学理工学部応用生物科学科の倉持幸司教授らは、抗菌・抗真菌活性やがん細胞に対する細胞毒性などを有することが知られている天然化合物N-アルキルフェナジノン類を容易に調製できる新規合成法の開発に成功し、さらに細胞毒性試験の結果、天然化合物よりもさらに高いがん細胞選択性を示す誘導体を見出すことができました。
ピオシアニン、ラバンズシアニンなどN-アルキルフェナジノン骨格を有する化合物は、Pseudomonas属やStreptomyces属などの細菌から単離される天然化合物です。有用な生物活性をさまざまに示すことが知られていますが、十分な量の試料の入手が困難であり、医薬品などへと展開するために必要な構造活性相関や作用機序などの知見は十分には得られておらず、簡便な化学合成法が求められていました。
本研究においてN-アルキルフェナジノン類を容易に調達可能な合成法が確立したこと、そしてそれらのうち、非常にがん細胞選択的な細胞毒性を有する化合物が見出されたことから、新たな抗がん剤としての応用を目指した開発研究が進むことが強く期待されます。本研究をまとめた論文は米国化学会発行の学術誌「ACS Omega」に掲載され、さらに掲載号のSupplementary Coverに選出されました。
 |
研究の背景
フェナジンは窒素原子を含む複素環式化合物であり、これまで100種類以上のフェナジン誘導体が天然化合物として同定され、さらには6,000種を超えるフェナジン類の化学合成が報告されています。その中で、N-アルキルフェナジノンは天然化合物としては11種しか知られておらず、Pseudomonas属やStreptomyces属などの細菌からこれまで単離されてきました。例えば緑膿菌(Pseudomonas aeruginosa)からはN-アルキルフェナジノンとしては最も単純な構造のピオシアニンが単離され、Streptomyces属の放線菌からはラバンズシアニン(別名WS-9659 A)やその2位の炭素原子にハロゲン原子(塩素または臭素)が結合した化合物(それぞれWS-9659 B、マリノシアニンA)、マリノシアニンAとは異なるアルキル基を有する化合物(マリノシアニンB)などが単離され、抗菌・抗真菌活性、がん細胞に対する細胞毒性、バイオフィルム形成、クオラムセンシング(自身と同種の菌の生息密度の感知と物質産生制御)、免疫反応抑制など、さまざまな生物活性に関わっていることが明らかになっています(図1)。
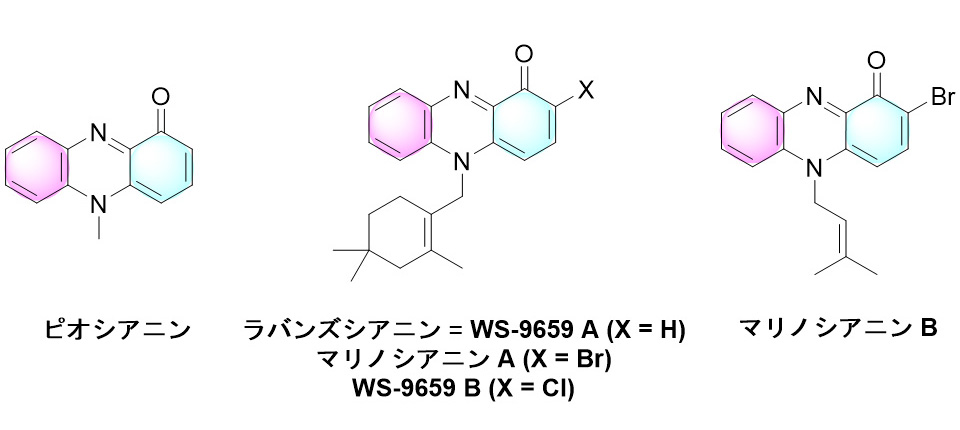 |
図1.本研究で注目した化合物の構造式
そのためN-アルキルフェナジノン類は医薬品としての応用に関心が持たれていますが、これまで簡便な合成法が確立されておらず、試料として十分な量の入手が困難であり、化学構造と生物活性との相関や作用機序などに関する知見が十分には得られていませんでした。倉持教授らの研究グループではN-アルキルフェナジノンおよびそのハロゲン化物の新規合成法の開発を目指して研究を開始し、まず昨年、N-アルキルベンゼン-1,2-ジアミンと1,2,3-ベンゼントリオールの酸化的カップリング反応が酸素雰囲気下に置くだけで進行してN-アルキルフェナジノン(ピオシアニン、ラバンズシアニン)が得られることと、それにN-ブロモスクシンイミド(NBS)を反応させると2位の炭素原子に臭素原子が結合した誘導体(マリノシアニンA、B)が得られることを報告しました。今回、さらに簡便な合成法の開発と共に、まだ得られていなかった塩化物の合成を試み、さらには得られたそれぞれの化合物の細胞毒性の評価を行いました。
研究結果の詳細
まず、上記の2段階合成(N-アルキルフェナジノンの合成と、それに続く2位の炭素のハロゲン化)を用いて塩化物の合成を試したところ、臭化物とは異なり、4位の炭素に塩素が選択的に結合した化合物が主成分として得られることが分かりました。4位の炭素のすぐ近くには比較的大きなN-アルキル基があり、立体障害によって臭素は4位よりも2位の炭素と結合する一方、塩素はファンデルワールス半径が臭素よりも小さいため、4位と結合してしまうことが示唆されました。そのため、本研究ではN-アルキルフェナジノンを合成した後に塩素化を行うという2段階合成ではなく、N-アルキルベンゼン-1,2-ジアミンと、もともと目的の位置が塩素化された4-クロロ-1,2,3-ベンゼントリオールをワンステップで酸化的カップリングさせることを試みました(図2)。酸化剤として酸素、1,4-ベンゾキノン、o-クロラニルをそれぞれ試し、この場合でも酸素の場合に最も高い収率が得られること、添加物として塩基である炭酸ナトリウム、炭酸カリウム、炭酸セシウムをそれぞれ添加した場合では炭酸セシウムの場合に収率が最も高くなることを見出しました。そのため、N-アルキルベンゼン-1,2-ジアミンと4-クロロ-1,2,3-ベンゼントリオール(または4-ブロモ-1,2,3-ベンゼントリオール)を酸素雰囲気下、炭酸セシウムを添加する条件で酸化的カップリング反応をそれぞれ行い、2位の炭素が塩素化または臭素化されたN-アルキルフェナジノンを計6種、合成することができました(塩化物:収率17~21%、臭化物:収率10~18%)。そのうち、ラバンズシアニンの2位の炭素が塩素化された天然化合物(WS-9659 B)はこれまで天然由来のものしか報告されておらず、初めての化学合成例です。
次に、2位の炭素がハロゲン化されていない3種のN-アルキルフェナジノンを含めて、今回合成した計9種のN-アルキルフェナジノンの細胞毒性とがん細胞に対する選択性を評価しました。9種それぞれを添加した条件で、ヒト前骨髄性白血病細胞(HL-60)、ヒト肺腺がん細胞(A549)、正常なヒト肺線維芽細胞(MRC-5)をそれぞれ培養し、IC50(細胞生存率が50%になる濃度:値が小さいほど細胞毒性が高い)を測定しました。また、MRC-5細胞に対するIC50をA549細胞に対するIC50で割った値(SI)をそれぞれ算出し、がん細胞に対する選択性の指標としました(SIが2を超えるとがん細胞に対する選択性があると言える)。結果、ラバンズシアニン(WS-9659 A)、WS-9659 B、マリニシアニンA、マリノシアニンB、マリノシアニンBの類縁体2種(置換基なし、および2位炭素を塩素化した化合物)の計6種はそれぞれの細胞に対する細胞毒性が高いものの、SI値が0.49~1.79と低く、肺腺におけるがん細胞選択性は低いことが分かりました。一方、構造のより単純なN-アルキルフェナジノン類(アルキル基はメチル基)の3種(ピオシアニン、2-クロロピオシアニン、2-ブロモピオシアニン)は、それらよりも細胞毒性は若干緩やかであるもののSI値が高く、特にピオシアニンはSI = 3.95、2-クロロピオシアニン(非天然化合物)はSI = 5.80と顕著ながん細胞選択性を示すことが明らかとなりました。本研究において一連のN-アルキルフェナジノン誘導体の簡便な合成法の開発に成功したため、研究グループでは今後、化学構造とがん細胞選択性の相関や作用機序についてさらに研究を進める予定です。
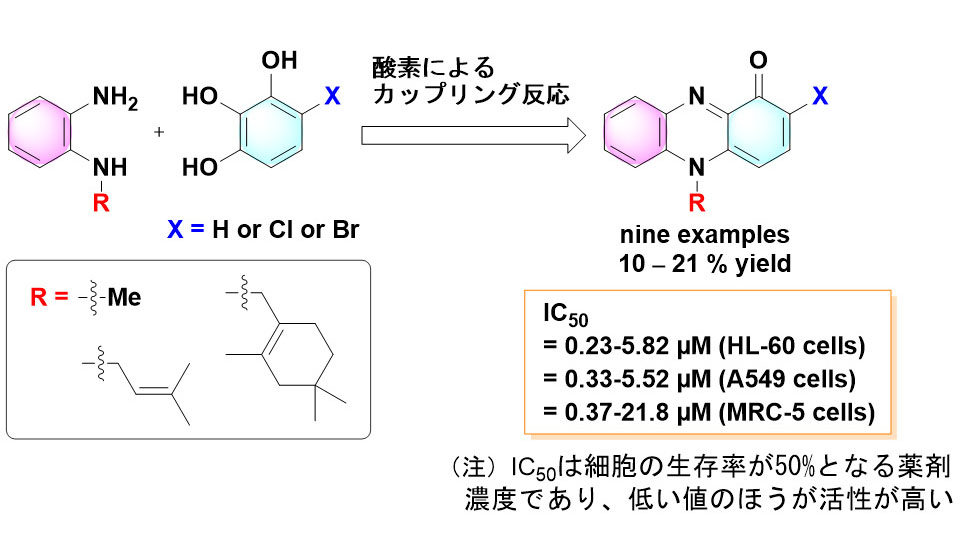 |
図2.本研究で開発した合成反応と合成化合物の細胞毒性活性評価
倉持教授は本研究の成果について、「2018年7月に妻をがんで亡くしました。三十代の若さでした。それ以来、がんの化学療法への発展を視野に入れて、がん細胞を選択的に死滅させる薬剤の開発に取り組んできました。本研究では正常細胞よりもがん細胞に強く作用する化合物を見出すことができました。一方、本論文で発見した化合物は細胞レベルでしか効果を確かめておりませんので、今後は動物レベルでの抗がん作用を検証し、もし動物レベルで効果が検証できた場合には安全性試験や臨床試験を進めていきたいです。本研究成果が新たな抗がん剤の開発につながること、ひいては患者さんやご家族に幸せをもたらせることを期待しています。」と話しています。
※本研究は、日本学術振興会科学研究費「基盤研究 C」(20K05868)の助成を受けて実施したものです。
論文情報
| 雑誌名 | : | ACS Omega |
|---|---|---|
| 論文タイトル | : | Synthesis and Cytotoxic Evaluation of N‑Alkyl-2-halophenazin-1-ones |
| 著者 | : | Haruki Kohatsu, Shogo Kamo, Masateru Furuta, Shusuke Tomoshige, and Kouji Kuramochi |
| DOI | : | 10.1021/acsomega.0c04253 |
倉持研究室
研究室のページ:https://www.rs.tus.ac.jp/kuramoch/
倉持教授のページ:https://www.tus.ac.jp/fac_grad/p/index.php?3bd3
東京理科大学について
東京理科大学:https://www.tus.ac.jp/
詳しくはこちら
