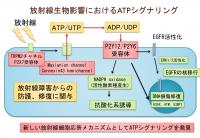
| トピックス |
1. Autocrine regulation of TGF-β1-induced cell migration by exocytosis of ATP and activation of P2 receptors in human lung cancer cells. Takai E, Tsukimoto M, Harada H, Sawada K, Moriyama Y, Kojima S. J Cell Sci. 2012 Nov 1;125(Pt 21):5051-60.
2. Autocrine Regulation of Macrophage Activation via Exocytosis of ATP and Activation of P2Y11 Receptor. Sakaki H, Tsukimoto M, Harada H, Moriyama Y, Kojima S. PLoS One. 2013;8(4):e59778.
3. Involvement of SLC17A9-dependent vesicular exocytosis in the mechanism of ATP release during T cell activation. Tokunaga A, Tsukimoto M, Harada H, Moriyama Y, Kojima S. J Biol Chem. 2010 Jun 4;285(23):17406-16.
4. Role of TRPM2 and TRPV1 cation channels in cellular responses to radiation-induced DNA damage.
Masumoto K, Tsukimoto M, Kojima S. Biochim Biophys Acta. -General Subject- 2013 Feb 28;1830(6):3382-3390.
5. Autocrine regulation of γ-irradiation-induced DNA damage response via extracellular nucleotides-mediated activation of P2Y6 and P2Y12 receptors.
Nishimaki N, Tsukimoto M, Kitami A, Kojima S.
DNA Repair (Amst). 2012 Aug 1;11(8):657-65.
6. P2X4 receptor regulates P2X7 receptor-dependent IL-1β and IL-18 release in mouse bone marrow-derived dendritic cells. Sakaki H, Fujiwaki T, Tsukimoto M, Kawano A, Harada H, Kojima S.
Biochem Biophys Res Commun. 2013 Mar 15;432(3):406-11.
|