内海 文彰 ウチウミ フミアキ UCHIUMI Fumiaki 教授
薬学部 生命創薬科学科
遺伝子制御学研究室
研究室紹介
- 専攻分野: 生化学、分子生物学
- 研究分野: 遺伝子発現制御機構の解明
生物の遺伝情報はDNAの暗号として保存されています。それはタンパク質の構造だけでなく、遺伝子がどの程度発現するかも決定しています。私たちは発がん、代謝や老化に関わる遺伝子、そしてインターフェロン応答性遺伝子の発現調節機構を解明するとともに、重要な働きをする遺伝子を発見し、その情報をもとに遺伝子を用いたがんや免疫疾患の新規治療法を目指した基礎的な研究を行っています。
研究テーマ
-
DNA修復関連遺伝子や老化関連遺伝子発現制御機構の解析
細胞増殖、老化、アポトーシスに関わる種々のヒト遺伝子5'-上流領域を単離しそれらのプロモーター活性や結合因子を解析する。
1. ヒト遺伝子プロモーター転写開始点付近に存在する重複GGAA配列の生物学的意義の解明
TATAボックスの存在しないプロモーター(TATAレスプロモーター)において転写を正に制御する重複GGAA配列の役割を細胞分化、増殖、アポトーシス誘導と関連づけて考察する。
2. 細胞老化関連遺伝子群発現制御機構の解明
細胞老化調節に関わる因子、テロメアの維持や伸長に関わる因子等をコードする遺伝子群の発現調節機構を解明する。
3. 細胞増殖停止や分化誘導に伴う種々の遺伝子発現変動の解析
種々の薬物処理、あるいは遺伝子発現ベクター導入により細胞増殖停止や分化を誘導した際におけるTP53やRB1等の遺伝子発現変動を解析するとともにそれら遺伝子のプロモーター活性調節メカニズムを明らかにする。 -
合成DNA配列によるプロモーターの構築
真核生物遺伝子の発現調節に関わるプロモーター領域には、必ずしも典型的なTATAボックスが存在していない。このようなTATAレスプロモーターは約7割程度存在する。そのような領域では、重複GGAA配列の存在する例が非常に多い。本研究では、重複GGAA配列を含む塩基配列を人為的に合成し、それらのプロモーターとしての機能を示すとともに、結合因子を特定することによってTATAレスプロモーターの分子制御メカニズムを明らかにする。
-
インターフェロン応答性遺伝子発現制御機構の解明
種々のヒトインターフェロン(IFN)応答性遺伝子(ISG)プロモーター領域を単離し、共通する転写因子結合エレメントのIFNや細胞分化誘導刺激に対する応答性について詳細に解析する。 また、天然あるいは化学合成化合物、あるいは遺伝子導入によりISG群の発現増大が可能となれば、IFN治療における副作用の問題を解決できるはずである。
-
ミトコンドリア機能関連遺伝子群プロモーター領域の解析
ミトコンドリア機能関連遺伝子群の発現調節に関わるプロモーターにはTATA配列ではなく重複GGAA配列の存在する例が多い。また、2方向性である例が多く、その場合にはパートナー遺伝子が存在する。がん細胞や老化細胞ではミトコンドリア機能の低下が認められるが、もしかするとこれは細胞内転写プロファイル変化によって自然に起こることかもしれない。
本プロジェクトでは、ミトコンドリア機能関連遺伝子群プロモーターを解析し、関与する転写因子を明らかにすることが目的である。最終的には転写因子導入によるがんの治療(予防)や老化の制御技術の確立を目指す。 -
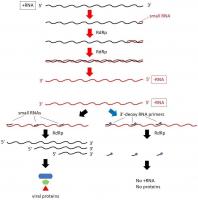
短鎖長RNA等を用いたSARS-CoV-2複製抑制実験
2019年に新型コロナウイルス感染症患者が最初に確認された。原因ウイルスSARS-CoV-2は、リボヌクレオチド鎖をゲノムとするRNA(+)ウイルスの一種である。実際は、世界的パンデミックとなる以前からコロナウイルスについての研究がなされており、そのライフサイクルや複製様式、ゲノムにコードされるタンパク質についての研究がなされていた。私たちが注目したのはRNA鎖を鋳型としてRNA鎖を伸長する酵素(RNA依存RNAポリメラーゼ)RdRpである。この酵素活性を特異的に阻害する、あるいはヌクレオチド塩基配列情報により設計された短いRNAを用いてウイルス増殖の抑制を目指す。